高二化学第一学期期中考试试卷A卷
原子量 H:1;C:12;N:14;O:16;S:32;Fe:56;Cu:64;Cl:35.5
一、选择题(每题只有一个答案符合题意,本题共20小题,每小题2分。)
1、下列气体中,不会对空气造成污染的是
( )
A、N2
B、NO
C、NO2
D、CO
2、下列分子中,具有极性键的非极性分子的是
( )
A、NH3
B、HCl
C、CO2
D、H2O
3、实验室制取下列气体中,与实验室制取氨气的发生装置相同的是
( )
A、H2
B、O2
C、Cl2
D、CO2
4、下列变化中,属于物理变化的是
( )
①红磷加热升华变成白磷 ②氯化铵晶体受热后由试管底部移到试管上部
③固体碘受热变成碘蒸气 ④干冰汽化 ⑤浓硝酸从无色液体变成黄色液体
A、①② B、③④ C、④⑤ D、③④⑤
5、某元素R的最高价氧化物的化学式为R2O5,它的气态氢化物中氢的质量分数为17.65%,则R的相对原子质量为
( )
A、31 B、14 C、16 D、32
6、起固定氮作用的化学反应是 ( )
A、氮气与氢气在一定条件下反应生成氨气
B、一氧化氮与氧气反应生成二氧化氮
C、氨气经催化氧化生成一氧化氮
D、由氨气制碳酸氢铵和硫酸铵
7、“光化学烟雾”的形成主要是由于
(
)
A、森林遭到乱砍滥伐,破坏了生态平衡
B、大气层中的臭氧层空洞
C、大气中二氧化碳的含量增多
D、汽车排出大量的尾气和硝酸工厂的废气
8、下列溶液中,不需要避光保存的是
(
)
A、硝酸银溶液
B、浓盐酸 C、浓硝酸
D、氯水
9、在氧化还原反应:3Cl2+6KOH====KClO3+5KCl+3H2O中Cl2
(
)
A、只是氧化剂
B、只是还原剂
C、既是氧化剂,又是还原剂 D、既不是氧化剂,又不是还原剂
10、2.0g氢气与32g氧气混合点燃,充分反应后生成的水的质量是 ( )
A、36g
B、34g
C、32g
D、18g
11、试管中盛有少量白色固体,可能是铵盐,检验的方法是
(
)
A、加水,将湿润的红色石蕊试纸放在试管口
B、加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C、加氢氧化钠溶液,加热,滴入酚酞试剂
D、加氢氧化钠溶液,加热,滴入紫色石蕊试剂
12、反应4NH3 (g) +
5O2(g)
4NO(g)+6H2O(g),密闭容器中进行,1分钟后水蒸汽的物质的量浓度增加了0.6 mol/L,则此反应的平均速率v(x)(反应物的消耗速率或生成物的生成速率)可表示为:
(
)
A.v(NH3)= 0.30
mol/(L·min)
B.v(O2)= 0.50
mol/(L·min)
C.v(NO )= 0.30 mol/(L·min)
D.v(H2O )= 0.50
mol/(L·min)
13、在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是( )
A、A、B、C三者的化学反应速率之比为1:3:2
![]()
![]() B、单位时间内生成amolA,同时生成3amolB
B、单位时间内生成amolA,同时生成3amolB
C、A、B、C的浓度不再变化
D、A、B、C的浓度相等
![]()
![]()
![]()
![]() 14、某混合气体12g,在标准状况下占体积5.6L,则该混合气体的平均相对分子质量是: ( )
14、某混合气体12g,在标准状况下占体积5.6L,则该混合气体的平均相对分子质量是: ( )
A 24
B 48
C 36
D 72
![]() 15、在一定条件下,发生CO+NO2
CO2+NO的反应,达到化学平衡后,降低温度,混合物颜色变浅,下列有关该反应的说法正确的是
(
)
15、在一定条件下,发生CO+NO2
CO2+NO的反应,达到化学平衡后,降低温度,混合物颜色变浅,下列有关该反应的说法正确的是
(
)
A、正反应为吸热反应
B、正反应为放热反应
C、降温后CO的浓度增大
D、降温后各物质的浓度不变
16、下列各反应达到化学平衡后,增大压强会使平衡向正反应方向移动的是( )
A、2NO2(g)
N2O4(g)
B、C(S)+CO2(g) 2CO(g)
C、H2S(g)
H2(g)+S(S)
D、4NH3 (g) + 5O2(g)
4NO(g)+6H2O(g)
17、下列说法正确的是
(
)
A、可逆反应的特征是正反应速率和逆反应速率相等
B、在其他条件不变时,升高温度可以使化学平衡向放热反应方向移动
C、在其他条件不变时,增大压强一定会破坏有气体存在的反应的平衡状态
D、在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化
学平衡状态
18、合成氨时采用500℃左右的温度进行,主要是因为在该温度时 ( )
A、合成氨的化学反应速率最大
B、N2的转化率最高
C、催化剂的活性最大
D、NH3的浓度最大
19、决定化学反应速率的主要因素是
(
)
A、物质的浓度
B、反应温度
C、物质的性质
D、压强
20、反应A+3B=====2C+3D在四种不同的情况下的反应速率为:①v(A)=0.10mol/(L·s);②v(B)=0.45mol/(L·s);③v(C)=0.30mol/(L·s);v(D)=0.30mol/(L·s),该反应在四种情况下进行的快慢顺序是
(
)
A、②>④>③>①
B、④>③=②>①
C、①>③>④>②
D、②=③>①=④
二、非选择题(本题60分)
21、氮分子的电子式是
,结构式为
;磷原子核外有
个电子,其最高价氧化物的水化物的化学式为
。(每空2分)
22、实验室分别制备:H2、NO2、CH4、NO气体时, 只能用排水法收集的气体是
_____; 只能用排空气法收集的气体是_______; 既能用排水法又能用
空气法收集的气体是_________。(每空1分)
23、影响化学反应速率的主要外界因素有 、
、 和催化剂
等。在其他条件不变的情况下,减小生成物的浓度的瞬间,可以使正反应
速率
,逆反应速率
。(每空1分)
![]() 24、反应2SO2+O2
2SO3,在定温、定容的密闭容器中进行。SO2和O2的最初
24、反应2SO2+O2
2SO3,在定温、定容的密闭容器中进行。SO2和O2的最初
浓度分别为3mol/L和2mol/L,达到平衡时有80%的SO2参加了反应,平衡
时各物质的浓度分别是c(SO2)= ,c(O2)=
,c(SO3)
=
。(每空3分)
25、配平下面氧化还原反应方程式:(每空1分)
( ) KMnO4+( )H2S+( )H2SO4---( )MnSO4+( )K2SO4+( )S↓+( )H2O
其中氧化剂是______, 被氧化的元素是______, 电子转移的总数是_______。
26、如图所示,实验室用NH4Cl和Ca(OH)2制取干燥的NH3
。试回答下列问题:
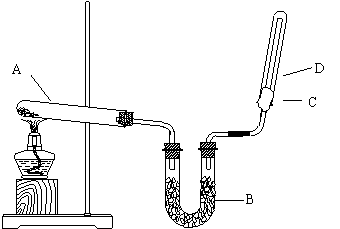
(1)写出NH3的电子式 和结构式
。(每空2分)
(2)B处为干燥装置,应放置的药品是
。(2分)
(3)用向下排空气法收集NH3时,C处棉花上应蘸取
。(1分)
![]()
![]() (4 ) 试管A发生的化学方程式为
(4 ) 试管A发生的化学方程式为
____________________________________________。(3分)
27、用硫铁矿(主要成分是FeS2,杂质不参与反应)制取硫酸,再用硫酸制取化肥硫酸铵[(NH4)2SO4]。今燃烧含FeS2 80%的硫铁矿100t,生产出132.0t硫酸铵。若在制取硫酸铵时硫酸的利用率为100%,试求FeS2转化为H2SO4的转化率。(发生的主要化学反应为4FeS2+11O2 高温 2Fe2O3+8SO2,2SO2+O2400℃`500℃
2SO3,
SO3+H2O=====H2SO4)(本题8分)
![]() 28、在常温下,在容积为2L的密闭容器中充入1molNO2,当反应2NO2
N2O4进行2min时达到平衡,测知有0.8molNO2转化为N2O4,试求平衡时:
28、在常温下,在容积为2L的密闭容器中充入1molNO2,当反应2NO2
N2O4进行2min时达到平衡,测知有0.8molNO2转化为N2O4,试求平衡时:
(1)、用N2O4表示在2min内反应的平均速率是多少?
(2)、N2O4的物质的量;
(3)、混合气体的相对分子质量。
第一学期期中考试试卷
 高一化学A卷答题卷
高一化学A卷答题卷
一、选择题(每题只有一个答案符合题意,本题共20小题,每小题2分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
二、非选择题(本题60分)
21、 ; ; ; 。(每空2分)
22、 ; ; 。(每空1分)
23、 ; ; ; ; 。(每空1分)
24、c(SO2)= ,c(O2)= ,c(SO3)= 。(每空3分)
25、 、 、 、 、 、 、 ; ; ; 。(10分)
26、(1) ; 。(4分) (2) 。(2分)
(3) 。(1分) (4) (3分)
27、(8分)
28、(7分)
期中考试高二化学A卷试卷参考答案
一、选择题(每题只有一个答案符合题意,本题共20小题,每小题2分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | C | B | B | B | A | D | B | C | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | D | C | B | B | A | D | C | C | D |
二、非选择题(本题60分)
21、略(每空2分)
22、 NO , NO2 , H2和CH4 。(每空1分)
23、浓度,温度,压强,不变,减小。(每空1分)
24、c(SO2)=0.6mol/L,c(O2)=0.8mol/L,c(SO3)= 2.4mol/L。(每空3分)
25、2、5、3、2、1、5、8; KMnO4; S ; 10 。(10分)
26、(1)略。(4分) (2)碱石灰。(2分)
(3) 水。(1分) (4)略(3分)
27、75% 8分
28、(1)0.1mol/(L·min) 3分
(2)0.4mol 2分
(3)76.7 2分
