高二化学第一学期期中考试试题3
化 学
第I卷(共72分)
计算所需数据:
H:1 C:12 N:14 O:16 S:32 Cl:35.5 Fe:56 Cu:64
一、选择题(本小题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意)
1.下列各元素中,在自然界里全部以化合态存在的是
A.硫 B.硅
C.碳 D.氮
2.下列物质中没有固定熔点的是
A.食盐 B.干冰
C.玻璃 D.石墨
3. 把铁矿石冶炼成铁的过程中,还原剂主要是
A. 铁矿石 B. 一氧化碳
C. 空气 D. 石灰石
4. 下列化学式能表示物质的一个分子的是
A. NaCl B. SiO2
C. CO2 D. P
5.下列物质属于纯净物的是
A.铝热剂 B.明矾
C.铁矿石 D.水玻璃
6. 随着人们生活水平的不断提高,废电池必须进行集中处理的问题被提到议事日程。其首要原因是
A.用电池外壳的金属材料
B.回收电池中的石墨电极
C.不使电池中的电解液腐蚀其它物品
D.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
7. 把Fe、Fe2O3、Cu的混合物放入稀硫酸中加热,充分反应后残渣中仍有铁和铜,则溶液中含有
A. Fe3+、Fe2+、SO42—
B. Cu2+、Fe2+、SO42—
C. H+、Fe3+、SO42— D. Fe2+、SO42—
8. 地壳是由多种元素组成的,其中质量分数占第一的非金属元素和占第一位的金属元素组成的化合物,符合实际的说法是
A. 易溶于水
B. 是酸性氧化物
C. 是碱性氧化物
D. 是两性氧化物
二.、选择题(本小题包括10小题,每小题4分,共40分,每小题有一个或两个正确选项符合题意。若正确答案只包含一个选项,多选时,该题为○分;若正确答案包含两个选项,只选一个且正确的给2分,选两个都且正确的给4分,但只要选错一个,该小题就是0分)
9. 下列离子方程式中,正确的是
A. Fe + Fe3+ = 2Fe2+
B. Fe3+ + Cl2 = Fe3+ + 2Cl—
C. 2Al + 2OH—+ H2O=2AlO2— + 2H2↑
D. SCN— + Fe3+
= [Fe(SCN)]2+
10. 往下列物质的溶液中通入CO2气体,有白色沉淀产生的是
A. Na2SiO3 B. Al(NO3)3
C. CaCl2 D. NaAlO2
11. 下列烃中,发生卤代反应时生成一卤代物同分异构体最多的是
A. 烷 B. 2-甲基丁烷
C. 2,2一二甲基丁烷 D. 环已烷
12. 下列各组离子在强碱性溶液中可以大量共存的是
A. Fe3+ K+ CO32— Cl— B. Na+ K+ AlO2— CO32—
C. Na+ Mg2+ NO3— SO42— D. Na+ Al3+ NO3— Cl—
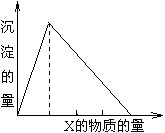 13. 将溶液(或气体)X逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图所示,则符合图中情况的一组物质是
13. 将溶液(或气体)X逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图所示,则符合图中情况的一组物质是
|
| A | B | C | D |
| X | H2S | HCl | NH3 | NaOH |
| Y | H2SO3 | NaAlO2 | AlCl3 | AlCl3 |
14. 2, 2, 3, 3-四甲基戊烷的结构简式是
A.(CH3)3CC(CH3)3
B.(CH3)3CCH2C
(CH3)3
C.(CH3)3CC (CH3)2 CH2CH3
D.(CH3)2C (CH3)C(CH3)3
15. 将小块钠放入过量的氯化铝溶液中,发生的现象为
A.只有气体放出
B.只生成无色透明溶液
C.有气体和白色沉淀生成 D.只有白色沉淀生成
16. 实验室制取甲烷需用碱石灰, 其作用是
A. 催化剂 B. 既做反应物又做干燥剂
C. 只做反应物
D. 只做干燥剂
17. 用铝箔包装0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到气体(标准状况下)为
A. H2、O2混合气体
B. 1.12L H2
C. >1.12L
H2 D. <1.12L
H2
18. 对于反应:Si
+2FeO ![]() 2Fe +
SiO2,下列叙述正确的是
2Fe +
SiO2,下列叙述正确的是
A. 它是炼铁高炉中的一种反应
B. 它是炼钢后期脱氧的一种反应
C. 它是用锰为还原剂焊接钢轨的一种反应
D. 它是炼钢前期生铁中合金元素被氧化的一种反应
第一学期泊头一中期中考试高二化学试题
化 学
第II卷(共78分)
班级: 姓名:
学号:
评分:
三.、(本题共3 小题,30分。)
19. (6分)写出下列反应的化学方程式
(1)
工业上用二氧化硅与碳在电炉中反应制粗硅:
;
(2) 实验室用制甲烷:
;
(3) 铁于过量的稀硝酸反应(写离子反应式):
。
20. (12分)某盐溶液的焰色反应呈紫色(透过蓝色钴玻璃观察),向此溶液中滴入少量盐酸,产生白色沉淀,继续加入过量盐酸时沉淀溶解,再加入过量氨水又产生白色沉淀,加过量氢氧化钠溶液沉淀又溶解。由此可知,该盐的名称为 。化学式为 。上述变化的离子方程式为:
, ,
, 。
21.(12分)含有较多Fe2+的溶液呈 色,含有较多Fe3+的溶液呈 色。往FeSO4的水溶液中滴加氨水,开始看到的现象是 ,离子方程式为:
;生成的难溶物在空气中露置后,继续看到的现象是: ;反应的离子方程式为: ;
加热上述反应最后生成的难溶物,反应的化学方程式是
。
四、(本小题共2小题,共16分)
22.(12分)下列固体中的少量杂质(括号内杂质),简述操作步骤,并写出有关变化的离子方程式:
| 物质 | 操作步骤 | 离子方程式 |
| SiO2(Al2O3) | ||
| MgO(Al2O3) | ||
| FeCl2(FeCl3) |
23.(4分).配平下列氧化还原反应方程式。
![]()
![]()
![]()
![]()
![]() FeSO4+ KMnO4+ H2SO4
Fe2(SO4)3 +
FeSO4+ KMnO4+ H2SO4
Fe2(SO4)3 +
![]()
![]()
![]() MnSO4+ K2SO4+ H2O
MnSO4+ K2SO4+ H2O
该反应中的氧化剂是 ,被氧化的元素是 。
五、(本小题共3 小题,共21分)
24.(8分) 写出下列各有机物的名称或结构简式
(1) 分子内含有14个H原子的直链烷烃 。
(2) 侧链中含有乙基的烷烃中分子量最小的是 。
(3) 2, 4, 6–三甲基–5–乙基辛烷 。
(4) 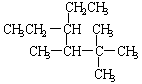 。
。
25.(9分)有A、B、C、D、E、F、G七种物质,它们的变化关系如下图所示:
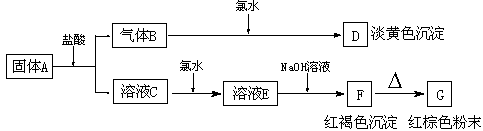 |
(1)写出下列物质化学式
A B C D E F G ;
(2)写出下列变化的离子方程式:
A®B+C
C®E
27.(4分)某无色透明溶液里加入铝粉可放出氢气,试分析下列离子:H+、Ba2+、Mg2+、、OH- 、SO32- 、Cl-、CO32-、NO3-中可能有哪些离子存在于该溶液中;
第一种情况:若溶液呈酸性,可能大量存在的离子是 ;
第二种情况:若溶液呈碱性,可能大量存在的离子是 。
六. (本小题共2小题,共11分)
28.(4分)含碳为83.3%的烷烃进行取代反应后得到的一氯代物只有一种。该烷烃的结构简式为:
,名称为: 。
29. (7分)在 500ml CuSO4和Fe2(SO4)3的混合溶液中加入16.8克铁粉,搅拌并充分反应后,经过滤、洗涤、干燥,可得6.4克铜。要使滤液中SO42-完全沉淀,需加入2.0mol∕L BaCl2溶液500ml。已知Fe3+的氧化性比Cu2+强,求
(1)溶液中SO42-的物质的量浓度
(2)原混合溶液中硫酸铜的物质的量浓度
