高二化学第一学期期中考试试题5
计算过程可能用到的原子量:H 1 Na 23 Mg 24 Al 27 Fe 56
O 16 S 32 N 14
第I卷(选择题 共72分)
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、随着人们生活质量的不断提高,废旧电池必须进行集中处理的问题已列入议事日程,其首要原因是
A、回收其中的石墨电极
B、防止电池中的Hg 、Cr 、Pb等重金属离子对水源和土壤造成污染
C、防止电池中渗泄的电解液腐蚀其他物品 D、再次回收利用电池外壳的金属材料
2、把一块Al、Fe合金放入足量盐酸中,通入足量的Cl2 ,再加过量NaOH 溶液、过滤,把滤渣充分灼烧,得到固体残留物恰好与原合金质量相等,则合金中Fe、Al质量比为
A、1:1 B、3:1 C、1:4 D、7:3
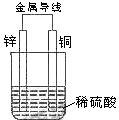 3、关于如图所示装置的叙述,正确的是( )
3、关于如图所示装置的叙述,正确的是( )
A、铜是负极,铜片上有气泡产生
B、铜片质量逐渐减少
C、电流从锌片经导线流向铜片
D、氢离子在铜片表面被还原
4、鉴定某一离子为亚铁离子,最好选用的方法是
A、加入NaOH溶液 B、加入KSCN溶液后再通入氯气
C、先通入足量氯气,再加入KSCN溶液 D、先加入足量铁粉,再加入KSCN溶液
5、用铝热法还原下列化合物,制得金属各1mol,消耗铝最少的是( )
A、Fe3O4 B、MnO2 C、WO3 D、Cr2O3
6、将钠、镁、铝0.3mol分别放入100mL1mol·![]() 的盐酸中,同温同压下产生的气体体积比是
的盐酸中,同温同压下产生的气体体积比是
A、1︰2︰3 B、6︰3︰2 C、3︰1︰1 D、1︰1︰1
7、只用一种试剂即可以鉴别AlCl3、FeCl2、FeCl3、MgCl2、CuCl2,该试剂是
A、NaOH B、HCl C、氨水 D、KSCN
8、某1L溶液中含0.1molFe2+、0.2molFe3+,加入0.2mol铁粉,充分反应后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A、0.3 mol/L B、0.4mol/L C、0.5mol/L D、0.6mol/L
二、选择题(本题包括10题,每小题4分,40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9、下列物质的水溶液中通入H2S,可以生成沉淀的有
A、氯化铁 B、氯化铝 C、氯化铜 D、氯化亚铁
10、下列有关说法正确的是
A、金属阳子被还原,一定得到金属单质
B、含有金属元素的离子一定是阳离子 C、NH4Al(SO4)2是一种复盐
D、已知由一种金属阳离子和两种酸根离子组成的盐是混盐,则CaCl2O属于混盐
11、盛放下列物质的容器长期敞口放置,其溶质因被氧化而变质的是
A、水玻璃 B、氯化亚铁 C、亚硫酸钠 D、漂白粉
12、下列反应的离子方程式正确的是
A、氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
B、氯化铁溶液通入SO2气体:2Fe3++SO2+2H2O=2Fe2++SO42—+4H+
C、向溴化亚铁溶液中滴加过量的氯水:Fe2+ + 2Br—+ 2Cl2= Fe3+ +Br2 + 4Cl—
D、氯化铝溶液与碳酸氢钠溶液反应:Al3++3HCO3—=Al(OH)3↓+3CO2↑
13、向一定量的稀硝酸中加入一定质量的铜、铁合金,合金完全溶解,则溶液中的阳离子组合不可能是
A、Fe3+、Fe2+、Cu2+、H+ B、Fe3+、Fe2+、Cu2+
C、Fe2+、Cu2+ D、Fe3+、Cu2+、H+
14、将一定量的铜与铁的混合物投入200mL2.25mol/L的硝酸中,固体完全溶解后,在标准状况下生成2.24L的NO(HNO3还原后的产物假定仅此一种),再向反应后的溶液中加入1mol/L的NaOH溶液,若要使溶液中的金属元素完全沉淀下来,所加入的NaOH溶液的体积最少应 A、350mL B、400mL C、500mL D、无法确定
15、铝、铍(Be)及其化合物具有相似的化学性质。已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断不正确的是
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2和盐酸反应的离子方程式:Be(OH)2+2H+=2H2O+ Be2+
D.Be(OH)2和NaOH反应的离子方程式:Be(OH)2+2OH—=2H2O+ BeO22—
16、将一定量含Fe3O4和Fe的混合物投入50 mL 2 mol/L H2SO4溶液中,在一定条件下固体混合恰好完全溶解,放出 448 mL(标准状况)下的气体,在所得溶液中加入KSCN溶液,无红色出现。如果用足量的CO在高温下与相同质量的此固体混合物充分反应,能得到铁的质量为
A、11.2g B、8.4g C、5.6g D、数据不足,无法计算
17、常温下,将铝与另一种材料用导线相连,并插入某电解质溶液中(括号内),构成原电池,其中铝可以做原电池的负极的是
A、铝、铜(浓硝酸) B、铝、镁(NaOH溶液)
C、铝、铜(盐酸) D、铝、镁(稀硫酸)
18、将等体积的AlCl3和NaOH两种溶液混合后,所得沉淀物中和溶液中所含铝元素的质量相等,则AlCl3和NaOH两种溶液的物质的量浓度之比是
A、1:3 B、2:3 C、1:4 D、2:7
第I卷(非选择题 共78分)
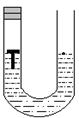 19、(10分)如图:U形管内有一枚铁钉,放置数天观察:
19、(10分)如图:U形管内有一枚铁钉,放置数天观察:
⑴若左侧U形管内液面上升,则溶液呈___________性,发生__ ______腐蚀,正极的电极反应式________________________。
⑵若左侧U形管内液面下降,则溶液呈___ _____性,发生_____ ____腐蚀,负极的电极反应式_______________________。
20、(1)(4分)画出铁的原子结构示意图 ,铁元素在元素周期表中的位置是 周期 族。
(2)(6分)已知铝土矿的主要成分是Al2O3,其中主要含有Fe2O3、SiO2等杂质,现用化学方法提纯铝土矿,甲、乙、丙、丁四位同学设计的方案如下:
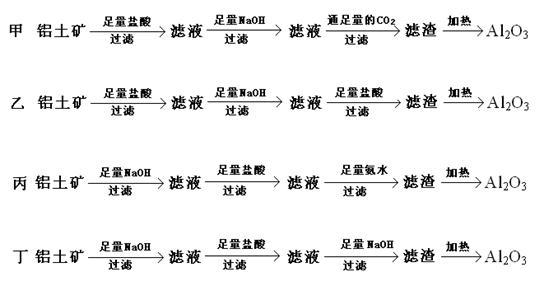
其中哪几位同学的方案是可行的 ,写出可行方案的第三步反应的离子方程式 ,
。(可填满也可以不填满,不够可以补充)
21、(8分)在下图中,横坐标为向一定量的某溶液中加入某种物质的量,纵坐标为生成沉淀的量。从图中,选择适合表中各题要求的序号填入表中
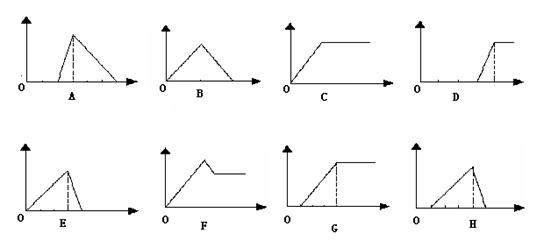
| 溶 液 | 加(或通入)物质 | 序号 |
| ⑴饱和石灰水 | 通入过量CO2 | |
| ⑵AlCl3溶液 | 加入过量浓氨水 | |
| ⑶含少量NaOH的NaAlO2溶液 | 通入过量CO2 | |
| ⑷含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 | |
| ⑸MgCl2、AlCl3混合溶液 | 逐滴加入NaOH溶液至过量 | |
| ⑹NaOH溶液 | 逐滴加入Al2(SO4)3溶液至过量 | |
| ⑺稀硫酸溶液 | 逐滴加入NaAlO2溶液至过量 | |
| ⑻含少量盐酸的AlCl3溶液 | 逐滴加入KOH溶液至过量 |
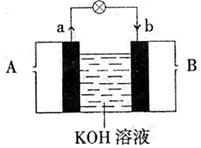 22、(11分)以多孔的铂为电极,采用右图装置在两极分别通入CH3OH和O2,使其在KOH溶液中发生反应产生电流,经测定,电子运动方向由a到b。
22、(11分)以多孔的铂为电极,采用右图装置在两极分别通入CH3OH和O2,使其在KOH溶液中发生反应产生电流,经测定,电子运动方向由a到b。
(1)A处通入的是 (填CH3OH或O2),是电池的 (正极或负极)
(2)电池的正极反应式是
(3)电池的总反应方程式是
(4)电池的负极反应式是
23、(8分)草酸晶体(H2C2O4)和浓硫酸混合缓慢加热时,可发生如下反应:H2C2O4= CO2+CO+H2O。某课外活动小组的学生设计了如下实验装置,用来制取干燥纯净的CO气体,并用生成的CO气体还原FexOy制取铁粉。
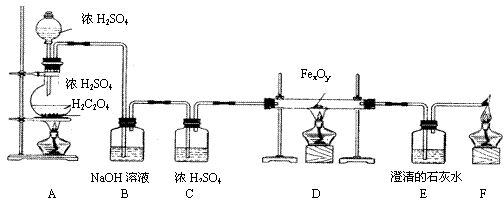 |
(1)装置B的作用是 。
装置E中的现象是 。
装置F的作用是 。
(2)装置D中玻璃管中发生反应的化学方程式为 ,
(3)若取一定量的FexOy,用7mol/L的盐酸100mL在一定条件下恰好完全溶解,所得溶液中再通入0.56L(标准状况下)氯气时,刚好使溶液中的Fe2+完全转化为Fe3+,则该该氧化物的化学式为 。
(4)在实验开始时,点燃A、D酒精灯的先后顺序是 ,实验完毕后,熄灭A、D酒精灯的先后顺序是 。
24、(10分)已知A是一种复盐,A溶液可以发生如下反应,C是一种能使湿润的红色石蕊试纸变蓝的气体,H是引起温室效应的主要气体之一,Y是一种常见液体,E的相对分子质量比D大16,L、K均为白色沉淀,且K光照后无变化。它们存在如下转化关系(反应条件及部分产物已略去):
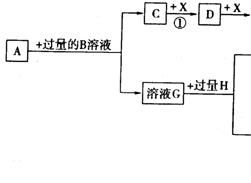
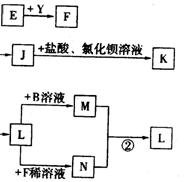
请回答下列问题:
⑴A的化学式是___________
⑵A与过量的B溶液反应的离子方程式_________ _____
⑶反应①的化学方程式是_________________ ___________。
⑷反应②的离子方程式是_________________ ___________。
⑸L与B的溶液反应的离子方程式______________
25、(12分)在标准状况下进行甲、乙、丙三组实验,三组实验各取相同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体的体积均为标准状况下测得):
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 670 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(1)乙组实验中,盐酸
(填“过量”、“适量”、或“不足量”)
(2)盐酸的物质的量浓度
(3)合金中Mg、Al的物质的量之比为
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,能使合金中的铝恰好完全溶解,不形成铝沉淀,并使Mg2+刚好完全沉淀。求所加NaOH溶液的体积。(写出计算过程)
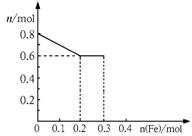 26.(9分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
26.(9分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
⑴甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 ___________g。
⑵乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 ____________________________。
⑶丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的一种离子的物质的量的变化曲线如下图所示,则该曲线表示的是 ___________物质的量变化的曲线,请你在此图中再画出另外两种离子的物质的量的变化曲线。
