高二化学第三次月考
试题
(考试时间90分钟,总分100分)
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Al—27 S—32
Cl—35.5 Ba—137
第I卷(选择题共50分)
一、选择题(共50分,每小题2分每小题只有一个选项符合题意。)
1. 反应 Fe +2HCl == FeCl2 +H2↑中,氧化剂是 ( )
A. Fe B. HCl C. FeCl2 D. H2
2. Na2CO3 固体中有少量的 NaHCO3 固体,除去 NaHCO3 固体选用的最好方法 ( )
A. 加热灼烧 B. 通入CO2气体 C. 加入氢氧化钠 D. 加入盐酸
3. 物质的量相等的 CO2 和 O2,它们 ( )
A. 原子数相等 B. 分子数相等 C. 质量相等 D. 质子数相等
4. 标准状况下,0.112 L 某气体的质量为 0.14 g,该气体可能是 ( )
A. HCl B. H2S C. N2 D. O2
5. 卤素单质按 F2、Cl2、Br2、I2 顺序,下列性质递变规律正确的是 ( )
A. 颜色由浅变深 B. 氧化性逐渐增强
C. 氢化物的稳定性逐渐增强 D. 密度依次减小
6. 用自来水养金鱼时,通常先将自来水晒一段时间再注入鱼缸,其主要目的是 ( )
A. 提高水温 B. 增加水中含氧量
C. 除去水中少量次氯酸 D. 用紫外线杀死水中的细菌
7. 你认为减少酸雨的产生可采取的措施是:①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源 ( )
A. ①②③ B. ②③④⑤ C. ①③⑤ D. ①③④⑤
8. 主族元素A有1个价电子,主族元素B的最高价与最低价的绝对值相等,它们形成化合物的化学式是 ( )
A. AB4 B. BA4 C. A2B D. B2A3
9. 现在,含有元素硒(Se)的保健品已开始进入市场。已知它与氧同族,与钾同周期。则下列关于硒的叙述中,不正确的是 ( )
A. 非金属性比硫强 B. 最高价氧化物的化学式是 SeO3
C. 硒是半导体 D. 气态氢化物的化学式为 H2Se
10. 下列物质中,只有共价键的是 ( )
A. NaOH B. NaCl C. NH4Cl D. H2O
11. 下列用途中,应用了氮气不活泼性的是 ( )
A. 用于合成氨气 B. 用液氮做制冷剂
C. 焊接金属时的保护气 D. 工业上以 N2为原料之一制硝酸
12. 根据下列变化,判断属于还原反应的是 ( )
A. HCl→Cl2 B. S→SO2 C. Fe(OH)3→Fe2O3 D. CuO→Cu
13. 在溶液中,下列各组离子能大量共存的一组是 ( )
A. H+、Ca2+、Cl—、HCO- 3 B. Na+、H+、NO- 3、Cl—
C. K+、Ba2+、Cl—、SO2- 4 D. Na+、H+、NO- 3、OH—
14. 下列离子方程式中,正确的是 ( )
A. 石灰石与盐酸反应:CaCO3 +2H+ == Ca2+ + CO2↑+ H2O
B. 氧化铁和稀硫酸反应:Fe2O3 + 6H+ == 2Fe2+ +3H2O
C. 氢氧化铜溶于盐酸:Cu2+ +2OH—+2H+ == Cu2+ +2H2O
D. 氯气溶于水:Cl2 + H2O == 2H+ + Cl— + ClO—
15. 下列说法正确的是 ( )
A. SiO2不溶于水,也不溶于任何酸
B. 硅酸的酸性比碳酸强
C. 玻璃中含有SiO2,一定条件下要与NaOH溶液反应
D. CO2和SiO2可发生化合反应
16. 下列各对物质中,互为同系物的是 ( )
A. C2H4、C8H18 B. CH3CHO、C2H5OH C. C2H6、C4H10 D. CH3COOH、C3H6
17. 某有机物的结构为CH2=CH—COOH,该氧化物不可能发生的化学反应是 ( )
A. 银镜反应 B. 加聚反应 C. 加成反应 D. 酯化反应
18. 在一个2L的容器中,盛入6mol某气态反应物。30s后测得这种气态反应物还剩5.4mol,这种反应物的化学反应速率为 ( )
A. 0.01 mol/L·s B. 0.012 mol/L·s C. 0.005 mol/L·s D. 0.03 mol/L·s
19. 氙和氟按一定比例混合,在一定条件下反应,达到以下平衡:Xe(g)+2F2(g)![]() XeF4(g)(正反应吸热)既能加快反应速率,又能使平衡向正反应方向移动的条件是 ( )
XeF4(g)(正反应吸热)既能加快反应速率,又能使平衡向正反应方向移动的条件是 ( )
A. 既升温又减压 B. 加压 C. 减压 D. 适当降温
20. 常温下,下列物质的水溶液的PH大于7的是 ( )
A. Na2CO3 B. Na2SO4 C. NH4Cl D. KCl
21. 等体积的盐酸和氢氧化钠溶液分别与两份足量铝粉反应,在相同条件下产生相同体积的氢气。则盐酸和氢氧化钠溶液物质的量浓度之比为 ( )
A. 1:1 B. 2:1 C. 3:1 D. 2:3
22. A、B、C都是金属,A中混有C时,A先腐蚀;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为 ( )
A. A>B>C B. A>C>B C. B>C>A D. B>A>C
23. 下列变化主要是由于被空气中的氧气氧化而变黄色的是 ( )
A. 工业盐酸呈黄色 B. KI溶液放置时间长了变黄色
C. 纯净的氢气在玻璃导管中燃烧的火焰呈黄色 D. 浓硝酸溅在皮肤上使皮肤呈现黄色
24. 用括号中的试剂除去下列物质中的少量杂质,正确的是 ( )
A. 溴苯中的溴(KI溶液) B. 甲烷中的乙烯(溴水)
C. 乙酸乙酯中的乙酸(乙醇) D. 二氧化碳中的氯化氢(KOH溶液)
25. 葡萄糖在人体内发生的氧化反应可用下式表示:C6H12O6(g)+6O2(g)→6CO2(g)+6H2O(l) 1mol葡萄糖完全氧化,放出 2804 KJ热量。某学生每天消耗热量 8412 KJ,若他摄取的淀粉有97.2%转化为葡萄糖,并全部被吸收,则该同学每日应摄取淀粉的质量是 ( )
A. 350g B. 486g C. 500g D. 540g
第II卷(非选择题共50分)
二、填空题(每空1分,共26分)
26. 2 mol NH4NO3中含有 mol N, mol O。
27. 红热的铜丝在氯气中剧烈燃烧,观察到的现象是 ,反应的化学方程式是 ,将生成物溶于水,溶液呈 色。
28. 已知2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是 ,氧化产物是 。若生成氯气11.2 L(标准状况),则转移电子的物质的量为 mol。
29. 硫酸铝水溶液呈 性(选填“酸”、“碱”或“中”),发生水解的离子方程式是
。
 30. 蛋白质、脂肪是重要的营养物质。它们水解的最终产物分别是:蛋白质→
,脂肪→ 和
。
30. 蛋白质、脂肪是重要的营养物质。它们水解的最终产物分别是:蛋白质→
,脂肪→ 和
。
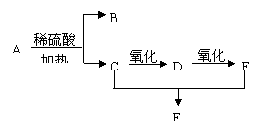
31. 化合物A的分子式为C3H6O2,有下列转化关系:
F能发生银镜反应。
(1)A的名称是
(2)B的结构简式是
(3)D中含有的官能团是
(4)写出C+E→F的化学方程式
32. X、Y、Z是VA→VIIA族的三种短周期元素,他们在周期表中的位置如图所示。
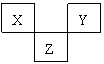 (1)X元素单质的化学式是
(1)X元素单质的化学式是
(2)Y元素的原子结构示意图是
(3)Z与Na所形成的化合物的化学式是 。
33. 在4个脱落标签的试剂瓶中,分别盛有盐酸、AgNO3溶液、BaCl2溶液、Na2CO3溶液。为了鉴别各瓶中的试剂,将他们分别编号A、B、C、D并两两混合,其实验现象为:A+B产生无色气体;B+C产生白色沉淀;A+D产生白色沉淀;B+D无明显变化。由此推断:
试剂A为 ,试剂D为 。
A+B反应的离子方程式为 ,
B+C反应的离子方程式为 。
34. 取1 mol/L AlCl3溶液60 mL,加入一定量的NaOH溶液,结果得到2.34 g的Al(OH)3沉淀。加入的溶液中NaOH的物质的量可能为 mol或 mol。
三、简答题(每空1分,共14分)
35. 误食铜盐、铅盐等重金属盐会使人中毒。这是因为 ;对误食重金属盐者,一种紧急解毒措施是让他们喝足量的 。
36. (1)过氧化钠在呼吸面具和潜水艇里作为氧气的来源,写出有关的化学方程式
。过氧化钠可用来漂白织物、麦杆、羽毛等,其原因是
。
(2)在一定条件下用普通铁粉和水蒸气反应可得到铁的氧化物,该氧化物可以被氢气还原,得到颗粒很细的铁粉,俗称“引火铁”。
写出普通铁粉和水蒸气反应的化学方程式 。将“引火铁”撒入装有氯气的集气瓶中,看见集气瓶内火星四射。实验时,需在集气瓶底铺一层细纱,原因是 。
(3)通常情况下,氮气的化学性质不活泼,其原因是 。写出氮气和氢气反应合成氨的化学方程式 。
37. 如图是一位同学设计的实验室制取氯气的实验装置图。
(1)指出这套装置中存在的错误 、 。
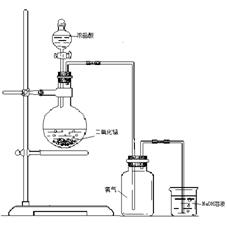 (2)烧杯里装有氢氧化钠溶液,其作用是
(2)烧杯里装有氢氧化钠溶液,其作用是
,发生反应的化学方程式是 。
(3)把Cl2通入NaBr溶液中,并向其中加入少量四氯化碳,振荡后静置,液体分为两层,上层为
色,下层为 色。
四、计算题(共10分)
38. 48 g某饱和一元醇与足量金属钠反应,得到16.8 L(标准状况)氢气。通过计算确定该一元醇的结构简式和名称。
39. 取100 mL Na2CO3和Na2SO4的混合液,加入过量BaCl2溶液后得到14.51 g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66 g,并有气体放出。试计算:
(1)原混合物中Na2CO3和Na2SO4的物质的量浓度。
(2)产生的气体在标准状况下的体积。