高二化学第四章单元测试(理科)
---几种重要的金属
一、选择题
1.我国古代湿法冶金术是世界闻名的,我国是世界上最先应用湿法冶金术冶炼的金属是
A.Fe B.Cu C.Ag D.Hg
2.下列用途主要是体现铝的物理性质的是:
①家用铝锅 ②盛浓硝酸的容器 ③制导线 ④焊接钢轨 ⑤包装铝箔
⑥制成合金作飞机制造业材料
A 只有①②③④ B 只有④⑤⑥ C 只有①③⑤⑥ D ②④⑥
3.下列化合物中,既能由单质直接化合制得,又能由复分解反应制得的是
A.CuS B.FeS C.Al2S3 D.FeCl2
4.下列金属①铁 ②镁 ③锰 ④钒 ⑤铬,可用铝热法制备的有
A.①②④ B.①②③⑤
C.①③④⑤ D.①②③④⑤
5.既能与强酸(H+)反应,又能与强碱(OH-)反应的是
①MgO ②Al(OH)3 ③NaHSO4 ④NaHCO3 ⑤(NH4)2CO3 ⑥CaCO3
A.② B.②③④ C.②④⑤ D.②③④⑤
6.某溶液可能含有硫酸盐、硝酸盐和氯化物,经测定得知溶液中含有浓度较多的H+、Fe2+和Ba2+,该混合物中的阴离子主要是:
A NO3- B Cl- C SO42- D Cl- 和SO42-
7. Al溶于NaOH溶液中,1molAl失去的电子被水获得,作氧化剂的H2O的物质的量为
A.1mol B.3mol C.4mol D.6mol
8. 能与Fe3+反应,且能证明Fe3+具有氧化性的是
①SCN- ②Fe ③Fe2+ ④Cu ⑤H2S ⑥OH-
A.①②③ B.②④⑤ C.①③⑥ D.①②⑤
9.下列叙述中不正确的是:
A. 金属的电化腐蚀比化学腐蚀普遍
B. 钢铁在干燥空气里不易腐蚀
C. 用铝质铆钉来接铁板,铁板反而易被腐蚀
D. 金属腐蚀的本质是M-ne-=Mn+而被损耗
10.镁粉投入下列溶液中,无气体产生的是
A.NaOH溶液 B.稀硫酸 C.稀硝酸 D.NH4Cl溶液
11.为了加快锌粉和稀硫酸反应放出H2的速率,可向稀硫酸中加入①锌粉②等浓度的硫酸③比原硫酸浓度大的稀硫酸④醋酸钠⑤铜粉⑥氧化铜⑦硫酸铜
A.①③ B.①⑤ C.③⑤⑥⑦ D.全部
12.把a、b、c、d四块金属板浸入稀H2SO4中,用导线两两相连可以组成原电池,若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c极上产生了大量气泡;b、d相连时,b极上有大量气泡产生,则四块金属的活动顺序为
A.a>d>b>a B.a>c>d>b C.a>b>c>d D.b>d>c>a
13.只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,
该试剂是
A.BaCl2溶液 B.FeCl2溶液
C.FeCl3溶液 D.Fe(NO3)3溶液
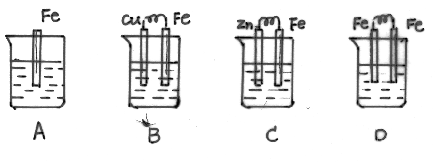
14.下列各容器中盛同样的海水,铁在其中被腐蚀时速率最快的是
|
15.向某溶液中加入过量盐酸,生成白色沉淀,过滤后向滤液中加入过量氨水使溶液呈碱性,又有白色沉淀生成,再过滤后又向滤液中加入Na2CO3溶液,再次生成白色沉淀。原溶液中含有的离子是
A.Cu2+、Ba2+、Ag+ B.Ag+、Al3+、Ba2+
C.Fe3+、Ca2+、Ba2+ D.Mg2+、Al3+、Ca2+
16.由FeO、Fe3O4和Fe2O3组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则该混合物中FeO、Fe3O4和Fe2O3的物质的量之比可能是
A.1:1:2 B.2:1:1 C.1:2:2 D.1:1:1
17.工业上利用下述反应在真空中炼铷:2RbCl+Mg MgCl2+2Rb.这一反应能进行的原因是
A.在高温下镁的金属活动性比铷强 B.铷的沸点比镁低,以气体形式被抽去
C.铷的熔点比镁低,以液体形式被抽去 D.MgCl2的稳定性比RbCl的强
18.以下现象与电化腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁蕊(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
19.能正确表示下列反应的离子方程式的是( )
A. FeCl2溶液中通入Cl2 : Fe2++ Cl2=2Cl— + Fe3+
B.铝和烧碱溶液: 2Al +2OH - +2H2O ====== 2AlO2- + 3H2↑
C. Fe投入盐酸中: 2 Fe+6 H+=2 Fe3++3 H2↑
D.氯化铝溶液中加入足量的氨水: Al3+ + 3OH - ====== Al(OH)3↓
20.现有100mL 3mol·L-1的NaOH溶液和100mL 1mol·L-1的AlCl3溶液,①将NaOH溶液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中。比较两次操作的现象是
A.现象相同,沉淀质量不等 B.现象相同,沉淀质量也相等
C.现象不同,沉淀质量相等 D.现象不同,沉淀质量不等
21.在托盘天平的两个托盘中,分别放两个质量相同的烧杯,烧杯中均盛有物质的量浓度、体积相等的盐酸,调整天平平衡,然后向两个烧杯中分别加入Fe、Zn各1g。天平不可能出现的变化是:
A.Fe这边上升 B.放Zn这边上升 C.仍保持平衡 D.以上三种均不可能
22、含ngHNO3的稀溶液恰好与mg铁粉完全反应,若HNO3只被还原为NO,则n:m可能是①5:1 ②9:2 ③3:1 ④2:1 ⑤4:1
A.②或③或⑤ B.①或③或④ C.②或③ D.①或③
23. 若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能大量共存的是
A.NH4+、NO3-、CO32-、Na+ B.Na+、Ba2+、Mg2+、HCO3-
C.NO3-、Ca2+、K+、Cl- D.NO3-、K+、AlO2-、OH-
24.用锌片、铜片和硝酸银组成的原电池,正极上发生的电极反应是
A.2H++2e-=H2↑ B.Zn-2e-=Zn2+
C.2H2O+O2+4e-=4OH- D.Ag++e-=Ag
25.a、b的活动性均比氢强,a可以从b的硝酸盐中置换出b。将a、b用导线相连放入CuSO4溶液中,下列叙述正确的是
A.导线上有电流,电流方向由a向b B.a棒质量减小,b棒质量增加
C.b棒上有H2产生 D.a棒上发生氧化反应,b棒上发生还原反应
26. 常温下,将100g铁投入一定量的硝酸中,不再反应后,取出洗净,质量为94.4g,若硝酸的还原产物是氮的氧化物,则反应中未被还原的硝酸为 ( )
A.0.1mol B.0.2 mol C.0.3 mol D.0.4 mol
二、填空题
27.绿矾晶体由于保存不妥或长久放置,容易部分或全部被氧化。现有一瓶绿矾样品,想了解其是否被氧化和被氧化的程度,试选择合适的试剂和操作,根据相关的实验现象进行推测。
(1)证明其完全没有被氧化的试剂是 ,现象是 。
(2)证明其已完全被氧化的试剂是 ,现象是 。
(3)通过怎样的实验和现象可说明其只是部分被氧化? ,涉及的离子方程式为 。
28.用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2 沉淀的操作是用长滴管吸取不含O2的NaOH溶液,
插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
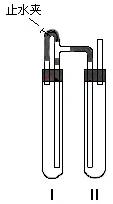 方法二:在如图装置中,用NaOH溶液、铁屑、
方法二:在如图装置中,用NaOH溶液、铁屑、
稀H2SO4等试剂制备。
(1)在试管I里加入的试剂是 。
(2)在试管II里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,
打开止水夹,塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,
其理由是 。
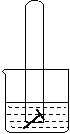 29.如图:水槽中试管内有一枚铁钉,放置数天观察:
29.如图:水槽中试管内有一枚铁钉,放置数天观察:
(1)若液面上升,则溶液呈现 性,
发生 腐蚀,电极反应式:
负极 ,正极 。
(2)若液面下降,则溶液呈 性,
发生 腐蚀,电极反应式:
负极 ,正极 。
30.称等质量的三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上带导管的塞子,一定时间后测定生成氢气的体积。甲加入50mL PH=3的盐酸;乙加入50mL PH=3的醋酸;丙加入50mL PH=3的醋酸及少量胆矾粉末。若反应终了,生成氢气的体积一样多。将甲、乙、丙用符号“>”、“=”、“<”表示它们之间的关系:
(1)开始时反应速率的大小为 。
(2)三试管中参加反应的锌质量为 。
(3)反应终了,所需时间为 。
(4)在反应过程中,乙、丙速率不同的理由是 。
三、推断题
31.黑色固体物质A有下图所示的转化关系,每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温为无色气体,其中C有臭鸡蛋气味;D、E有共同的阳离子,D中加入KSCN溶液显红色。

(1)写出B和C的化学式:B 、C 。
(2)写出反应④的离子方程式: 。
四、计算题
32.由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,则当在铜片上共放出3.36L(标准状况)气体时,H2SO4恰好全部用完,产生这些气体消耗锌多少克?有多少个电子通过了导线?原稀H2SO4的物质的量浓度是多少?
33.31.9克由Al、BaCl2、Na2CO3粉末组成的混合物,放入200 mlNaOH溶液中进行反应,收集到标况下气体13.4升。过滤后,在部分滤液中加入铝片无气体产生,在另一部分滤液中加入足量的H2SO4(稀),既无气体,又无沉淀生成。将滤渣溶解在盐酸中,可收集到标况下气体G 7.84升。求:
(1)NaOH溶液的物质的量的浓度。
(2)气体G的组成和密度。
(3)混合物中铝的质量分数。
几种重要的金属单元测试答题卷(理科)
班级: 姓名: 学号:
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
二、填空题
27.(1) ; ;
(2) ; ;
(3) ; ;
28.方法一:
(1) ;
(2) ;
(3) 。
方法二:
(1) ;
(2) ;
(3) ;
(4) 。
29.(1) ; ;
;
(2) ; ;
;
30.(1) ;
(2) ;
(3) ;
(4) 。
三、推断题
31.(1) ; ;
(2) 。
四、计算题
32.
33.