高中学生学科素质训练
高二化学测试题(二) 烃(3—4节)
本试卷分第一卷(选择题)和第二卷(非选择题)两部分,共100分,考试时间为60分钟。
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.某烃通式为CnH2n,关于该烃的下列说法中正确的是 ( )
A.一定是烯烃 B.一定是不饱和烃
C.能使溴水或酸性KMnO4溶液褪色 D.燃晓时生成CO2和H2O的物质的量相等
2.通常用于衡量一个国家石油化工发展水平的标志是 ( )
A.石油的产量 B.乙烯的产量 C.天燃气的产量 D.汽油的产量
3.主链上有4个碳原子的某种烷烃有2种同分异构体,含有相同碳原子数且主链上也有4个碳原子的单烯烃的同分异构体有 ( )
A.3种 B.2种 C.4种 D.5种
4.下列说法中错误的是 ( )
A.C2H6与C5H12一定是同系物
B.C2H4与C3H6一定是同系物
C.烯烃的各同系物中碳的质量分数都相等
D.随着碳原子数的增加,烯烃同系物的沸点逐渐升高
5.现有两种烯烃:CH2=CH2和CH2=CR2(R为烃基),它们的混合物进行聚合反应后,产物中含 ( )
![]()
![]()
![]()
![]()
![]()
![]() ① [ CH2—CH2 ]n ② [ CHR—CHR ]n ③ [ CH2—CH2—CH2—CR2 ]n
① [ CH2—CH2 ]n ② [ CHR—CHR ]n ③ [ CH2—CH2—CH2—CR2 ]n
![]()
![]()
![]()
![]() ④ [ CH2—CH2—CHR—CHR]n ⑤ [ CH2—CR2 ]n
④ [ CH2—CH2—CHR—CHR]n ⑤ [ CH2—CR2 ]n
A.①⑤ B.②④ C.①③⑤ D.只有①
6.含有一个参键的烃,与H2完全加成后的产物为 ( )
|
,该烃可能的结构有 ( )
A.1种 B.2种 C.3种 D.4种
7.某烃室温时为气态,完全燃烧后,生成的H2O和CO2的物质的量之比为3:4,该不饱和烃的链烃的同分异构体的数目应是 ( )
A.2 B.3 C.4 D.5
8.某气态烃0.5mol能与1molHCl完全加成,加成后产物分子上的氢原子又可被3molCl2取代,则此气态烃可能是 ( )
A.![]() B.CH2=CH2
B.CH2=CH2
C.![]() D.CH2=C(CH3)CH3
D.CH2=C(CH3)CH3
二、选择题(本题包括6小题,每小题4分,共24分,每小题有一或两个选项符合题意。)
9.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型化合物。判断下列反应产物正确的是 ( )
A.ZnC2水解生成乙烷 B.Al4C3水解生成丙炔(C3H4)
C.Mg2C3水解生成丙炔(C3H4) D.Li2C2水解生成乙烯(C2H4)
10.下列关于乙烯和乙烷比较的说法中,不正确的是 ( )
A.乙烯属于不饱和链烃,乙烷属于饱和链烃
B.乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,原子不在同一平面上
C.乙烯分子中的C=C双键和乙烷分子中的C—C单键相比较,双键的键能大,键长长。
D.乙烯能使酸性KMnO4溶液褪色,乙烷不能
11.关于炔烃的叙述中不正确的是 ( )
A.分子里含碳碳叁键的不饱和链烃
B.易发生加成反应,也易发生取代反应
C.能使酸性高锰酸钾溶液褪色,又能使溴水褪色
D.分子里所有的原子都处在一条直线上
12.若用乙炔作为有机合成的原料,下列过程可能生成产物CH2Br—CHBrCl的是( )
A.先加HCl再加Br2 B.先加HCl再加HBr
C.先加Cl2再加HBr D.先加Cl2再加Br2
13.有机合成工业中原子利用率高、原料来源丰富、价格低廉且无污染,称其为“绿色化学”。以下反应中符合绿色化学原理的是 ( )
A.乙烯和氧气在银催化下生成环氧乙烷
B.乙烷与氯气制备一氯乙烷
C.60℃时,乙炔与H2O在硫酸汞酸性溶液中合成乙醛
D.乙醇与浓硫酸共热制备乙烯
14.以下物质中与1—丁烯不是同系物的是 ( )
A.乙烯 B.2—甲基—2—丁烯
C.环丙烷 D.2—丁烯
第Ⅱ卷(非选择题,共52分)
三、(本题包括2小题,共19分)
15.(13分)实验常用酒精和浓硫酸共热制乙烯,试回答下列问题。
(1)酒精和浓硫酸的体积比为 ,混合时将 倒入 ,否则会 ,然后加入少量 ,以免混合液加热时 。
(2)该反应的化学方程式为 ,反应中浓硫酸的作用是 。
(3)气体发生装置中的温度计应插在 。
(4)实验中要使温度迅速升高到170℃的原因是 。
(5)实验室通常用排水法而不用排气法收集乙烯,其原因是 。
(6)混合液逐渐变黑的原因是 ,产生的气体有明显的刺激性气味,这是由于发生了反应 。
16.(6分)下列是有关实验室制取乙炔的实验问题,按要求回答。
(1)为了控制水与电石的反应速率并得到平稳的气流,采取的措施是 。
(2)用试管制取少量乙炔时,在试管上部放置一团疏松的棉花,其作用是 。
(3)实验产生的气体有难闻的气味,这是因为电石中含有 杂质。
(4)实验室制取下列气体时,不能使用启普发生器的是 。
A.用大理石和盐酸反应制CO2
B.用电石和水反应制C2H2
C.用锌粒和稀硫酸制H2
D.用亚硫酸钠和硫酸制SO2
四、(本题包括2小题,共14分)
|
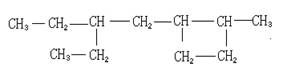
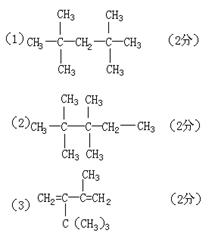
18.(8分)某烷烃A蒸气的密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
(1)若A不可能是烯烃与氢气加成的产物,A的结构简式为 。
(2)若A是炔烃与氢气加成的产物,A的结构简式为 。
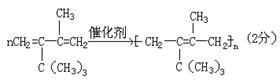
(3)若A是共轭二烯烃(具有1,3—丁二烯的单、双键结构)与氢气加成的产物,写出该共轭二烯烃的结构简式 ,其合成高聚物的化学方程式:
。
|
19.(10分)(1)某链烃的分子式为C6H4,其分子中已有1个碳碳双链( ),则含碳
碳叁键(![]() )
个。某链烃的分子式为C200H200,则分子中含碳碳叁键最多是
个。
)
个。某链烃的分子式为C200H200,则分子中含碳碳叁键最多是
个。
(2)已知碳原子数小于或等于8的单烯与HBr反应,其加成产物只有1种结构。
①符合此条件的单烯烃有 种,判断的依据是 。
②在这些单烯烃中,若与H2加成后,所得烷烃的一卤代物的同分异构体有3种。这样的单烯烃的结构简式为 。
20.(9分)某链烃(CnHm)属烷烃、烯烃、炔烃中的一种,使若干克该烃在足量的氧气中燃烧,生成XLCO2及1L水蒸气(393K,1.01×10-5Pa)。试讨论:如何根据X的不同的取值范围来确定该烃所属的类型及其分子内所含碳原子数n的值(用含X的表达式或实际数值范围表示)填写下表。
| 链烃类别 | x的取值范围 | n值 | |
| ① | 烷烃 | ||
| ② | 烯烃 | ||
| ③ | 炔烃 |
高 二 化 学 测 试 题 答 案
(二)
1.D 2.B 3.A 3.A 4.B 5.C 6.B 7.C 8.C 9.C 10.C 11.BD 12.A 13.AC 14.CD
|
|
|
(3)反应混合液中。(1分)
|
(5)乙烯的密度与空气接近,用排气法收集将使乙烯中混有空气(1分)
(6)浓硫酸使乙醇炭化;(1分)
|
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
16.(6分)(1)用饱和食盐水代替水。(1分)
(2)避免生成的Ca(OH)2糊状物将导气管口堵塞。(1分)
(3)Ca3S2、Ca3P2、Ca3As2等因态物质(1分)
(4)BD;(1分)
对于(B),反应生成的Ca(OH)2呈糊状物会堵塞反应容器,使水面难以升降,另外,此反应放出大量的热,会损坏启普发生器。对于(D),亚硫酸钠易溶于水且生成的SO2极易溶于水。(2分)
|
| ||||
17.①CaCO3 CaO+CO2 ②CaO+3C CaC2+CO↑
|
![]() ③CaC2+2H2O Ca(OH)2+CH
③CaC2+2H2O Ca(OH)2+CH![]() CH↑ ④2NaCl+2H2O
CH↑ ④2NaCl+2H2O 2NaOH+H2↑+Cl2↑
|
| ||||
![]()
|
⑦nCH2=CHCl
|
|
9.(10分)
(1)2;50(每空2分,共4分)
(2)①7;单烯烃结构的对称性(每空2分,共4分)
②CH3CH2CH=CHCH2CH3;②(CH3)2CH=CH(CH3)2(每个结构简式1分,共2分)
(9分)
①![]()
②x=1;(1分)n≥2(n为正整数)(2分)
③1<x≤2;(1分)![]()