高二化学创新能力测试卷
一、选择题(本题共15分。有5小题,每小题3分。每小题只有一个选项符合题意)
1.“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应原
子全部转化为欲制得的产物,即原子利用率为100%。用甲烷合成乙酸乙酯,欲使原子
利用率达到最高,还需要消耗的其他的反应物有
A、 CO B、 CO2和H2O C、 H2O和O2 D、 CH3OH和O2
2.常温下,0.1mol/L的下列各物质的溶液中,阳离子浓度最大的是
① BaCl2 ②MgCl2 ③AlCl3 ④NaF
A、 ② B、③ C、④ D、一样大
3.下列各物质溶液中,指定粒子浓度之间的关系不正确的是
A、饱和NH4Cl溶液中:c(H+)+c(Cl—)=c(NH4+)+2c(NH3•H2O)+c(OH—)
B、0.1 mol/L的NaHCO3溶液中:c(HCO3—)+c(CO32—)+c(H2CO3—)=0.1 mol/L
C、饱和NaHS溶液中:c(Na+)>c(HS—)>c(H+)>c(OH—)
D、0.1 mol/L的CH3COONa溶液中:c(CH3COO—)>c(OH—)
4.在抢救大出血的危症病人时,常需静脉点滴输予0.9%的氯化钠溶液(俗称“生理盐水”),
是由于人体血液的“矿化度”(即无机盐含量)为0.9%,另有研究表明,30亿年前地表
原始海水的矿化度即为0.9%,对此,下列猜测或评论中不足取的是
A.人类祖先可能是从原始海洋中逐渐进化到陆地上来的
B.人体血液和原始海水之间存在着某些尚未认识的关系
C.人体血液和原始海水的矿化度均为0.9%纯属巧合
D.人体血液仍然带有原始海水的某些印痕
5.一定温度和压强下,乙腈(CH3CN)是极易溶于水的无色液体,这时向质量分数为a的乙腈
水溶液中加入等体积的水,所得溶液中乙腈的质量分数为0.4a。若同样条件下乙腈的密
度为d1,水的密度为d2,则下列说法正确的是
A.d1<d2 B.d1>d2 C.d1=d2 D.无法确定
二、选择题(本题共40分。10小题,每小题4分。每小题有1~2个正确答案)
6.未知元素M、N都是短周期元素,原子半径N > M,它们可形成常见化合物MN2,由此可得出的正确判断是
A.M、N可能在同一周期 B.M在N的下一周期
C.M肯定是金属元素 D.N可能在第三周期的VIA族或VIIA族
7.尿酸是人体的一种代谢产物,关节炎形成的原因就是在关节的滑液中形成尿酸钠(通常用
NaUr表示)晶体:
HUr+H2O====Ur -+H3O+ …… ① Ur -+Na+====NaUr ……②
第一次关节炎发作的时间大都在寒冷季节,发病部位常常是手指的关节处,下列推测正确
的是
A.反应②是吸热反应 B.热敷可以使关节炎的症状减轻有一定的道理
C.NaUr易溶于水 D.关节炎发病时关节滑液的pH降低
8.过碳酸钠晶体(其化学式为2Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质。
下列物质能使过碳酸钠较快失效的是
 A.MnO2 B.H2S C.稀Na2SO4 D.NaHCO3
A.MnO2 B.H2S C.稀Na2SO4 D.NaHCO3
9.有如下变化:
且 ΔH1<ΔH2。下列说法正确的是
A、 氧化性A<B B、还原性An—<Bn— C、稳定性A<B D、稳定性An—<Bn—
10.现有22gZn、Fe二种金属粉未的混合物与一定量的28.5%硫酸反应恰好完全反应,得到
无水盐70g,则生成气体的体积(标准状况)为
A、 11.2L B、 5.6L C、 16.8L D、 无法确定
11.为了消除“白色污染”,化学工作者研制了许多种可降解塑料,其中一种为:
![]() 该塑料在微生物作用下可较快水解成小分子。若用甲
该塑料在微生物作用下可较快水解成小分子。若用甲
醇处理此塑料,能得到的有机物为
A 乙二醇 B 对苯二甲酸二甲酯 C 苯 D 苯甲酸
12.组成某蛋白质的氨基酸平均相对分子质量为128,测得此蛋白质的相对分子质量为5646,
由此可以推断该蛋白质含有的肽链数和氨基酸个数依次为(假定肽链之间无化学键连接)
A 3和44 B 3和51 C 2和44 D 2和51
13.已知盐酸和氢氧化钠溶液的中和热为ΔH1=-57.3kJ/mol,则稀醋酸与氢氧化钠(稀)的中
和热一般情况下约为
A 大于-57.3kJ/mol B 等于-57.3kJ/mol C 小于-57.3kJ/mol D 无法比较
14.锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗(Ge)元素处于最高价态,铋元素(Bi)的价态与它跟氯形成某种共价氯化物所呈的价态相同,且此氯化物中铋具有8电子稳定结构。BGO的化学式是
A 、 Bi3Ge3O15 B、 Bi4Ge3O12 C、 Bi4Ge3O16 D、 Bi3Ge3O12
15.化学上鉴定S2O32—的方法之一是使用AgNO3溶液作试剂,将AgNO3溶液逐滴滴入含有
S2O32—的溶液中,会发生如下反应:
Ag+ +2 S2O32—==[Ag(S2O3)2]3— 3Ag+ +[Ag(S2O3)2]3—== Ag2S2O3↓(白)
Ag2S2O3 +H2O== Ag2S↓(黑)+H2SO4 对于S2O32—的鉴定,下列叙述不正确的是
A 、该鉴定可在酸性溶液中进行 B 、 AgNO3溶液过量
C、 S2—对该鉴定有干扰 D、 该鉴定可在中性或碱性溶液中进行
三、选择题(本题共15分。有5小题,每小题3分。每小题只有一个正确答案)
16.对反应A(g)+B(g) ![]() 3C(g),在一恒压容器中进行。取相同量A、B为
3C(g),在一恒压容器中进行。取相同量A、B为
起始原料,分别在不同温度下发生反应,反应进行相同时间后,测定A在混合物中的
 百分含量,得如图曲线:
百分含量,得如图曲线:
下列说法正确的是
A.该反应吸热 B.A点处于平衡状态
C.B点处于平衡状态 D.C点处于平衡状态
17.向200ml0.1mol/LFe(NO3)2溶液中加入适量NaOH,使Fe2+恰好完全沉淀,小心加热此
混合物,直到水分蒸干,然后灼烧到质量不再变化,此时固体的质量为
A 4.36g B 5.54g C 4.84g D 5.00g
18.等质量的下列各组混合物完全燃烧生成CO2的质量由大到小是
①C2H6 C3H8 ②C3H4 C3H6 ③C3H6 C2H4 ④C4H10 C3H8 ⑤C2H2 C3H4
A. ①②③④⑤ B. ②③⑤④① C. ⑤②③④① D. ⑤②③①④
19.在通式为CnH2n-6苯的同系物中,如果只有一个侧链的各异构体在浓硫酸与浓硝酸的条
件下,生成主要的一硝基取代物共有8种,则此n值为
A、 8 B、 9 C、 10 D、 12
![]() 20.反应:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)已达平衡。若增大压强,平衡移
20.反应:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)已达平衡。若增大压强,平衡移
动,但混合气体的平均相对分子质量不变。下列说法正确的是
A、原混合气体的平均相对分子质量为30 B、原混合气体的平均相对分子质量为28
C、起始时,NH3与CO2的体积比为13:14 D、起始时,NH3与CO2的体积比为14:15
四、填空题(共38分)
21.(6分)三种互为同系物的含氧衍生物的分子量M分别为M1、M2、M3,成等差数列,公差为28,且M∈(73,131);每种分子中均含有3个氧原子,但都不与金属Na作用放出氢气。试写出此三种有机分子的结构简式: 、 、
22.(6分)X、Y是短周期元素,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数可能是: n+3、 n-7 、n+11 、 、 、 。
23.(8分)四种未知稀溶液A、B、C、D,它们分别是HCl、BaCl2、Na3PO4、Na2SO4、中的某一种。唯一可选用的试剂是AgNO3溶液。某学生用他们做了三次实验,每次实验中都无明显现象。这三次实验是:
(1)A加入C中,(2)B加入A中,再向混合液中加C,(3)AgNO3溶液加入D中。
根据上述实验结果,对于A、B、C、D四种物质能确证的是_______,_____,______,_________。(填写分子式及对应的A、B、C、D,例A为××。四空格可填满,也可不填满)。
24.(8分)C12和NO2在室温下化合生成一种新的气态化合物C(没有其它产物)。为了测定C的分子组成,进行以下实验:取原混合气体5 L,测定反应后总体积随C12在混合气体中所占体积分数(x)的变化规律。实验测知:当C12所占体积分数为20%或60%时,反应后的总体积均为4 L。
(1)通过分析和计算求得化合物C的分子式为 ,发生反应的化学方程式为 。
(2)试讨论当x的取值范围不同时,反应后总体积(y)随x变化的函数关系。_________ 。
25.(10分)2002年,南京发生了特大投毒案,经分析研究发现,死者的肠胃中残存了一种名叫“毒鼠强”的化学物质A。元素分析发现:含C:20%、S:26.7%、O:26.7%、N:23.3%。已知一个A分子中有两个硫原子。
1).试确定A的化学式 。
2).A分子中所有相同元素的化学环境相同。试画出A分子的结构式 。
3).若在碳原子上发生取代,问一卤代物、二卤代物和三卤代物各有 、 、 种。
五、有机题
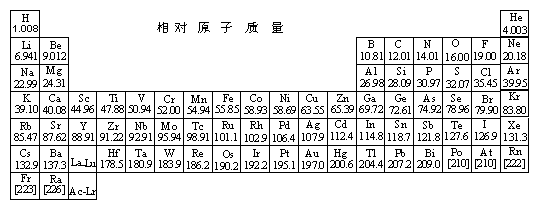
26.(8分)人体对维生素的需要量虽少,但一旦缺乏,人体就不能正常发育,还会引起疾病,下面是两种维生素的结构简式:

维生素C极易发生下列反应:
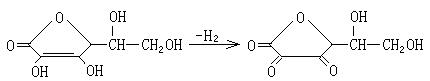
(1)维生素A1的化学式为 ,从结构上看,它应属于 。
A、酚类 B、不饱和醇类 C、饱和一元醇 D、芳香族化合物
(2)可用碘溶液测定柠檬汁中维生素C的含量。写出维生素C与I2反应的化学方程式_____。
27.(11分)已知:
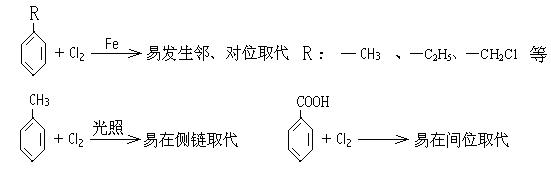
某有机物A的相对分子质量为198.5,A跟氯气反应,在铁粉存在下只有一个氢原子被取代时能得到两种有机产物,而在光照下只有一个氢原子被取代时,只能得到一种有机产物;A跟NaHCO3反应,产生使石灰水变浑浊的无色气体;A在NaOH存在下水解后的溶液用硝酸酸化,再加入硝酸银溶液,会立即生成白色沉淀。
A在一定条件下可发生下列一系列反应,最终生成D和F;
(1) 写出下列物质的结构简式:A: C: D: F:
(2) 指出下列变化的反应类型:① A→B: ② C→D: ___ ③ C→E:
六、实验题
| 沸点(0C) | 水 溶 性 | |
| 甲醇 | 65 | 与水混溶 |
| 甲醛 | -21 | 与水混溶 |
28.(11分)在实验室可利用下列反应制HCHO:2CH3OH
+O2 ![]() 2HCHO+2H2O ,关于甲醇和甲醛的沸点和水溶性见下表。实验中,有关物质流经的主要装置如下,
2HCHO+2H2O ,关于甲醇和甲醛的沸点和水溶性见下表。实验中,有关物质流经的主要装置如下,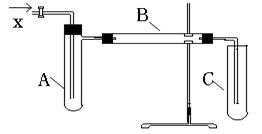
请回答下列问题:
(1)通入A管的X是什么物质
(2)在A、B、C管中反应,各装的是什么物质 、 、 。
(3)该实验中需要加热的仪器是(选填A、B、C) 。
(4)在加入必需的试剂后,继续实验的主要操作步骤依次为 (选择合适的操作及次序)。
①通X气体②加热A处③加热B处④加热C处⑤撤A处酒精灯⑥撤B处酒精灯⑦撤C处酒精灯⑧停止通入X气体⑨撤C处导管
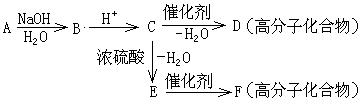
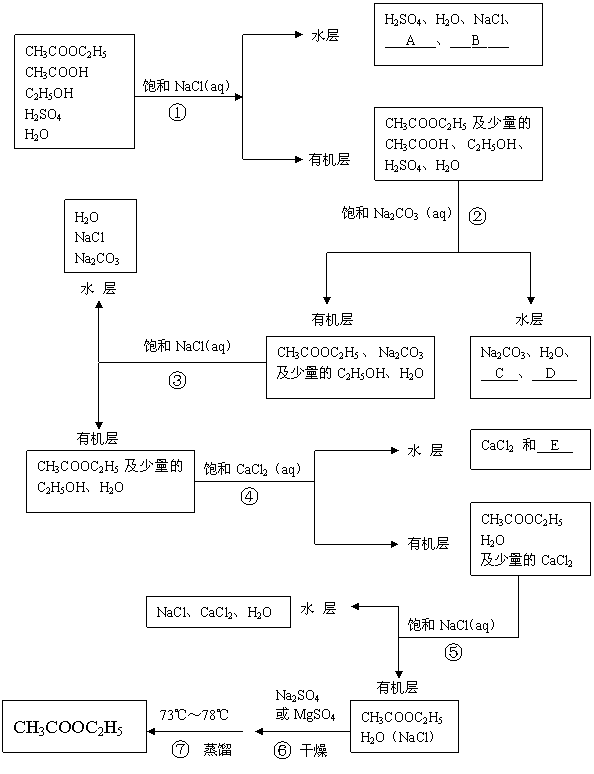
29.(14分)当乙酸与乙醇在硫酸作用下加热回流酯化后,最后反应混合物中含有乙酸、乙醇、乙酸乙酯、水和硫酸。现将乙酸乙酯提纯,流程如下页,请回答有关问题。
(1)写出A、B、C、D的化学式A___________B___________C___________D___________,
E的化学成分测定中发现物质的量关系n(Cl):n(H)=1:12,写出E的化学式__________。
(2) ②步骤实验目的是什么__________;该操作在什么化学仪器中进行?_______________。
⑥步骤中加入的MgSO4或Na2SO4的作用是什么?_________________________________
(3) 步骤①得到的水层中要检验出H+、SO42-、Cl-离子,三位学生进行了不同的实验:
甲同学:取少量溶液先滴加石蕊溶液,再加入BaCl2溶液,取上层清夜加入AgNO3溶液。
乙同学:取少量溶液先加先加入足量Ba(NO3)2溶液,再取上层清夜加入AgNO3,再加入少量NaHCO3粉末。
评价二位同学实验的合理性。甲_______乙_______(填“合理”或“不合理”)。如不合理,请说明原因__________________________________(如合理,此空不填)
丙同学认为以下做法能达到目的,但要控制试剂的用量:取少量溶液先滴加石蕊溶液,再加入Ba(OH)2溶液,取上层清夜加入AgNO3溶液。
请说明丙同学如何控制试剂量______________________________________________。
 |
七、问题和计算
30.(8分)如图所示装置中,容器甲内充入0.100 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体,恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时,体积缩小至最小,为原体积的9/10。随着CO2的继续通入,活塞又逐渐向右移动。
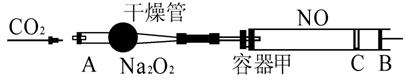 |
(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g,此时,通入标准状况下的CO2气体多少L?容器甲中NO2转化为N2O4的转化率是多少?
②活塞移至C处后,继续通入amolCO2,此时活塞恰好回至B处。则a值必小于0.0100,其理由是 .
(2)若改变干燥管中的Na2O2质量,可通过调节甲容器的温度及通入CO2的量,使活塞发生从B到C,又从C到B的移动,则Na2O2的质量最小值应大于 。
高二化学创新能力测试卷答案
一、选择题
二、选择题
三、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | B | C | C | A | D | BC | AB | BC | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | D | A | B | AD | D | A | C | C | A |
四、填空题
21、H-![]() -O-
-O-![]() -H,CH3-
-H,CH3-![]() -O-
-O-![]() -CH3,CH3CH2-
-CH3,CH3CH2-![]() -O-CH2CH3
-O-CH2CH3
22、 n + 1 n + 2 n – 5
23、D-Na2SO4、A-HCl
24、(1)NO2C1;2NO2+C12===2NO2C1
(2)当0<x<1/3时,y=5-5x;当1/3≤x<1时,y=5-5(1-x)/2
25、(1)C4H8S2O4N4
(2)
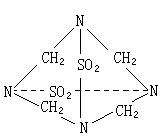
(3)1 3 3
五、有机题
26、(1)C20H30O B
(2)
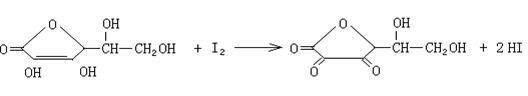
27、(1)
(2) ①水解 ②缩聚 ③消去
六、实验题
28、(1)空气或氧气
(2)甲醇 铜粉(铜网) 水
(3)A B
(4)③②①⑨⑥⑤⑧ 或 ③①②⑨⑥⑤⑧
29、
(1)A:CH3CHHO B:C2H5OH C:CH3COONa D:Na2SO4 E:4C2H5OH·CaCl2
(2)除去H2SO4和CH3COOH 分液漏斗
(3)吸水剂 甲不合理 乙合理 甲引入Cl-干扰Cl-的检验 加入Ba(OH)2至沉淀不再产生,溶液红色仍不褪去
七、计算题
30、(1)①解:设通入的CO2为X,生成的O2为Y
2 Na2O2 + 2 CO2 = 2 Na2CO3 + O2 Δm
2 1 56
X Y 2.24
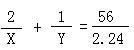
X = 0.08 mol Y = 0.04 mol
V(CO2)= 0.08 mol × 22.4 L/mol = 1.792 L
n(NO剩余)= 0.1 moL – 0.08 mol = 0.02 mol
所以 生成n(NO2) = 0.08 mol
设生成的N2O4为Z
![]()
Z = 0.01 mol
W(NO2)转化率 = 0.01 mol×2 / 0.08 mol × 100% = 25.0%
②因为 2 NO2 ![]() N2O4
,当再通入CO2时,各气体的分压减少,使平衡向逆反应移动。
N2O4
,当再通入CO2时,各气体的分压减少,使平衡向逆反应移动。
(2)1.56 g