高二化学氮族元素
1、某元素R的最高价氧化物的化学式为R2O5,它的气态氢化物中氢的质量分数为17.65%,则R的相对原子质量为
A.31 B.14 C.16 D.32
2、下列关于氮族元素叙述错误的是
A.铋的价电子数虽大于4,但属于金属
B.随原子序数的递增,原子半径逐渐增大
C.单质的熔沸点随原子序数递增而逐渐升高
D.氮族元素的非金属性要比同周期氧族元素弱
3、下列叙述正确的是
A.VA族元素在化学反应中都可形成-3价的阴离子
B.VA族元素形成的氢化物,按N®Bi顺序它们的还原性依次减弱
C.VA族元素形成的单质,除氮外常温下均是固体
D.VA族元素都能形成+3、+5价化合物
4、C、N、O、F按从左到右顺序,下列说法中正确的是
A.非金属性递增 B.氧化性递增
C.气态氢化物稳定性递减 D.单质的颜色逐渐加深
5、某元素R原子的最外层上有5个电子,它的含氧酸的钾盐的化学式不可能是
A.KRO3 B.K3RO4 C.KRO2 D.K2RO4
6、氮气能大量存在于空气中,且能维持固定含量的最主要因素是:
A.N2是非极性分子 B.N2难溶于水
C.N2比空气稍轻 D.N2分子结构稳定
7、通常情况下气体能共存的是
A.N2、O2 B.NH3、HCl C.NO、O2 D.H2S、SO2
8、某无色混合气体可能含有O2、N2、NO或NO2中的两种,混合气体经放电后呈现红棕色,原混合气体是:
A.N2、NO B.N2、NO2 C.NO、O2 D.N2、O2
9、将充满等体积的NO和NO2混合气体的试管倒置于水槽中,试管内液面上升的最大高度约为试管的:
A.1/3 B.1/4 C.1/5 D.2/3
10、硝酸酐是
A.N2O4 B.NO2 C.NO D.N2O5
11、CO2与NO共30ml,将混合气体通过足量的Na2O2固体并充分反应后,气体体积缩小到20ml,原混合气体中NO的体积是
A.10ml B.15ml C.20ml D.25ml
12、区分某红棕色气体是溴蒸气还是NO2气体,可采用的试剂是
A.蒸馏水 B.KI-淀粉试纸
C. AgNO3溶液 D.NaOH溶液
13、含1mol CO、1mol NH3和1 mol NO的气体混合物,某实验室的工作者拟通过下述操作,从其中分离出纯而干燥的CO:(1)通过浓烧碱溶液;(2)通过浓H2SO4;(3)加入0.5mol O2,正确操作次序是
A.(2)(3)(1) B.(3)(1)(2)
C.(2)(1)(3) D.(3)(2)(1)
|
|
14、如图1所示,室温下,两个容积相等的烧瓶中分别集满了A和B两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是
| 编号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | O2 | HCl | O2 |
A.②③④① B.③①④②
C.③②①④ D.④③②①
15、某集气瓶呈红棕色,加入足量水,盖上玻璃片振荡,得棕色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色,该气体可能是下列混合气中的
A.N2、NO2、Br2 B.NO2、NO、N2
C.NO2、O2、NO D.N2、O2、Br2
16、N2中混有少量CO2气体和水蒸气,除去的正确操作是
A.通过无水CaCl2的干燥管
B.通过浓硫酸的洗气瓶
C.先通过NaOH溶液的洗气瓶,再通过浓硫酸的洗气瓶
D.先通过浓硫酸的洗气瓶,再通过NaOH溶液的洗气瓶
17、砷为第四周期第ⅤA族元素,则砷不可能具有的性质是:
A.砷在通常状况值下是固体
B.砷可以有-3,+3,+5等多种化合价
C.As2O5对应水化物的酸性比H3PO4弱
D.砷的还原性比磷弱
18、关于氮族元素的如下论述中错误的是:
A.随原子序数递增原子半径逐渐增大
B.最高价氧化物对应水化物酸性依次减弱
C.都是典型的非金属元素
D.最高化合价均为+5价
19、氮族元素可能组成的阴离子有:
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
20、下列混合物可以用加热法分离的是
A.碘和NH4Cl B.BaCl2和NH4Cl
C.食盐和砂 D.KClO3和MnO2
21、标准状况下, 1体积水吸收560体积氨气所得氨水的密度是0.90g / mL, 该氨水的物质的量浓度是
A.4 mol / L B.8 mol / L C.10 mol /L D.16 mol / L
22、将碳酸氢铵在试管中加热, 使放出的气体依次通过盛有足量过氧化钠和水的容器, 最后得到的气体是
A.O2 B.CO2 C.NH3 D.H2O
23、能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶溶液加以区别的一种试剂是
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.NaOH
24、通常状况下,下列气体中最易溶解于水的是
A.SO2 B.Cl2 C.NH3 D.CO2
25、氮的固定是指
A.将氨转变为硝酸或其它氮的化合物
B.将空气中的氮气转变为氮的化合物
C.植物吸收施入土壤的氮肥作养料
D.将一氧化氮和氧气反应转变为其它氮的化合物
26、下列电子式中书写正确的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
27、在冷的浓硝酸中,下列金属最难溶解的是
A.银 B.镁 C.铝 D.铜
28、下列大气污染物中,能与人体血红蛋白结合而引起中毒的气体是
A.SO2 B.NO2 C.H2S D.NO
29、下列各组气体在常温下,极易发生非氧化还原反应而不能共存的是
A.氨气和氯化氢 B.硫化氢和二氧化硫
C.一氧化氮和氧气 D.氯气和硫化氢
30、下列各组离子能大量共存于同一溶液中的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
31、用一种试剂可把![]() 四种无色溶液加以鉴别(必要时可加热),此试剂是
四种无色溶液加以鉴别(必要时可加热),此试剂是
A.BaCl2溶液 B.AgNO3溶液
C.NaOH溶液 D.Ba(OH)2溶液
32、下列各组物质发生化学反应时,若反应物的量或反应条件发生变化时,可得到不同产物的是
①P、Cl2 ②Cu、HNO3 ③Na、O2 ④CO2、NaOH ⑤C、O2
A.只有①③④⑤ B.只有①②③④
C.只有②③⑤ D.全部都可以
33、下列物质的实验室存放方法中,错误的是
A.氢氟酸存放于塑料试剂瓶中
B.白磷存放于盛有二硫化碳的试剂瓶中
C.金属钾存放于盛有煤油的试剂瓶中
D.浓硝酸存放于棕色试剂瓶中
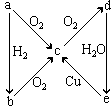
34、某元素的单质a及其化合物b、c、d、e在一定条件下可发生如图所示变化,则该元素可能是
A.硫元素 B.氯元素
C.磷元素 D.氮元素
35、砷(As)元素的原子序数为33,下列关于砷元素的叙述不正确的是
A.最高价氧化物的化学式为As2O5
B.其气态氢化物的稳定性强于磷化氢而弱于硫化氢
C.砷单质在通常状况下为固态
D.砷酸是一种弱酸,酸性比磷酸酸性弱
36、下列各组单质分别与浓硝酸混合,出现的情况依次是:①反应生成相应的硝酸盐;②反应生成最高价含氧酸;③常温下呈钝态;④不发生反应。符合上述情况的单质组是
A.Cu、Si、Zn、Au B.Ag、P、Al、Pt
C.Fe、C、Pb、Hg D.Cu、S、Fe、Au
37、下列化合物中既有离子键又有共价键的化合物是
A.Na2O2 B.NH3 C.NH4Cl D.HCl
38、将浓硝酸加热分解,用排水法收集分解产物,最后集气瓶内充满的物质是
A.NO B.NO2 C.O2 D.稀硝酸
39、在标准状况下,往1升NO中不断地通入O2,若温度、压强保持不变,则反应后的气体体积Y与通入O2的体积X的关系如下图所示,其中正确的是
40、室温时,在体积相同的密闭容器中混合下列气体,混合后容器内压强最小的是
A.100mL H2和50mL O2 B.100mL NO和50mL O2
C.100mL HCl 和 50mL NH3 D.100mL H2S 和 50mL SO2
41、0.3摩Cu2S与足量浓硝酸反应生成硝酸铜、硫酸、一氧化氮和水。则参加反应的硝酸中,未被还原的硝酸的物质的量为
A.2.2摩 B.1.0摩 C.1.2摩 D.0.6摩
*41、在右图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4摩/升NaOH溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | 1摩/升盐酸 |
42、各取0.1摩铜分别投下足量的下列四种酸中(必要时可以加热),①浓硫酸;②稀硫酸;③浓硝酸;④稀硝酸,完全反应后,在相同条件下所得气体体积由大到小的顺序是
A.②④①③ B.③①④② C.①②④③ D.③④①②
43、将10ml 0.2摩/升的含氧酸HxRO4溶液与20ml 0.15摩/升的某碱M(OH)a溶液混合,恰好完全反应,则R元素的化合价为
A.+5 B.+6 C.8-1.5a D.8-3a
44、将20ml NO2和NH3的混合气体在一定条件下充分反应,化学方程式是6NO2+8NH3==
7N2+12H2O,已知参加反应的NO2比NH3少2ml(气体体积均在相同条件下测定)。则原混合气体中NO2和NH3的物质的量之比是
A.3∶2 B.2∶3 C.3∶7 D.3∶4
金属(镁、铝、铁)
45、称取两份铝粉,第一份加足量NaOH溶液,第二份加足量硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是
A.1∶2 B.1∶3 C.3∶2 D.1∶1
46、两种金属粉末的混合物13g,投入足量的稀硫酸中,在标准状况下产生11.2 L气体,则这种合物可能的是
A.Zn、Al B.Fe、Zn C.Al、Mg D.Mg、Cu
47、燃着的镁条在下列气体中不能继续燃烧的是
A.CO2 B.N2 C.Cl2 D.He
48、下列物质能否在自然界中大量稳定存在
A.Mg B.Mg(OH)2 C.MgCl2 D.KAlO2
49、在强碱性溶液中能大量共存,并且溶液为无色透明的离子组是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
50、用下列哪种方法可以制得Al(OH)3沉淀
A.往硫酸铝溶液里滴加过量的氨水
B.往氯化氢溶液里加入过量的烧碱溶液
C.往偏铝酸钠溶液里通入过量的二氧化碳气体
D.往偏铝酸钾溶液里滴加过量的盐酸
51、下列物质中既能与强酸溶液反应,又能与强碱溶液反应,且都有气体逸出的是
A.NaHCO3 B.Al2O3 C.Al D.(NH4)2S
52、将下列各组物质,分别按等物质的量混合后加水溶解,有沉淀生成的是:
A.![]() B.
B.![]()
C.![]() D.
D.![]()
53、镁、铝、铜三种金属粉末的混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有:
A.AlO![]() B.
B.![]() C.
C.![]() D.
D.![]()
54、下列离子方程式中书写正确的:
A.AgNO3溶液跟NaCl溶液反应 ![]()
B.Cl2跟KI溶液反应 ![]()
C.H2SO4跟Ba(OH)2溶液反应 ![]()
D.Fe跟FeCl3溶液反应 ![]()
55、镁条在空气中燃烧后得到的生成物是:
A.只有MgO B.只有Mg3N2
C.Mg3N2和MgO D.MgCO3
56、用等体积等浓度的氯化钡溶液,可使相同体积的硫酸铝、硫酸镁、硫酸钠三种溶液中的SO![]() 完全转化为BaSO4沉淀,则这三种硫酸盐溶液的物质的量浓度之比是:
完全转化为BaSO4沉淀,则这三种硫酸盐溶液的物质的量浓度之比是:
A.1∶3∶3 B.3∶3∶1
C.1∶1∶3 D.3∶3∶1
57、5.4克铝跟一定量的硝酸在一定温度下全部反应,收集到的气体(NO、NO2)体积为11.2L(标准状况)则反应的硝酸物质的量可能为:
A.0.8mol B.0.9mol C.1.1mol D.1.2mol
58、Na、Mg、Al各0.2mol,分别放入0.1mol/L稀HCl 1L中,产生H2的质量分别为a、b、c则三者关系正确的是:
A.a∶b∶c = 1∶2∶3 B.a∶b∶c = 2∶1∶1
C.a∶b∶c = 6∶3∶2 D.a∶b∶c = 1∶2∶2
59、2.6克金属混合物的粉末跟足量盐酸反应,产生2.24L(标准状况)氢气此金属混合物的成份可能是:
A.Mg和Al B.Mg和Cu C.Fe和Al D.Fe和Cu
60、既能跟强酸反应又能跟强碱反应的正盐是:
A.NaHCO3 B.Al(OH)3 C.FeS D.(NH4)2SO3
61、将Na2O2放入FeCl2溶液中,可观察到的现象是:
A.放出无色气体,产生白色沉淀,稍后沉淀由白色变灰绿,最后到红褐色
B.放出无色气体,立即产生红褐色沉淀
C.放出无色气体,溶液变为棕黄色
D.放出黄绿色有刺激性气味的气体
62、某无色溶液加入铝可以生成氢气,则在该溶液中不可能大量存在的离子组是:
A.![]() B.
B.![]()
C.![]() D.
D.![]()
63、利用铝合金代替铝制钥匙是利用铝合金的
A.熔点低 B.不易锈蚀 C.硬度大 D.密度小
64、下列熔合物的固体属于合金的是
Al与Cu ‚Fe与C ƒK与Na „Al与Si
A.都是 B.只有ƒ C.只有‚„ D.只有
65、用铝热法还原下列化合物,制得金属各1mol,需消耗铝最少的是
A.MnO2 B.WO3 C.Co3O4 D.Cr2O3
66、我国最新报道的高温超导体中,铊是组成成分之一,已知铊与铝是同族元素,关于铊的判断有错误的是
A.铊是质软的银白色的金属
B.铊能生成+5价化合物
C.铊能置换出盐酸中的氢
D.铊能与氧气发生反应
67、有关Al与NaOH溶液的反应的说法中,正确的是
A.铝是还原剂,其氧化产物是Al(OH)3
B.NaOH是氧化剂,其氧化产物是H2
C.铝是还原剂,H2O和NaOH都是氧化剂
D.H2O是氧化剂,Al被氧化
68、某强酸性溶液中,可以大量共存的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
69、下列各化学反应的离子方程式中,有错误的是
A.氢氧化铝与盐酸反应:![]()
B.氧化铝溶于氢氧化钠溶液:![]()
C.碘化钾溶液中滴入溴水:![]()
D.氢氧化铝溶于氢氧化钠溶液:![]()
70、以氧化铝为原料制取氢氧化铝,最好的方法是
A.将氧化铝溶于水。 B.将氧化铝先溶于盐酸中,之后滴加氨水。
C.将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液。
D.将氧化铝溶于氢氧化钠溶液中,之后滴加盐酸。
71、500mL 0.1mol/L的NaCl溶液与100mL 0.1 mol/L的AlCl3溶液中Cl-离子浓度之比为
A.5∶1 B.5∶3 C.1∶3 D.5∶2
72、现在![]() 五种溶液只用一种试剂把它们区别开,这种试剂是
五种溶液只用一种试剂把它们区别开,这种试剂是
A.氨水 B.AgNO3 C.浓NaOH D.NaCl
73、下列物质的溶液中,通入过量的CO2,发生化学反应,但不会析出沉淀的是
A.Na2SiO3 B.NaAlO2 C.Na2CO3 D.NaOH
74、向含有1mol
KAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使![]() 恰好转化为沉淀,此时生成的Al(OH)3的物质的量是
恰好转化为沉淀,此时生成的Al(OH)3的物质的量是
A.1mol B.1.33 mol C.0.67mol D.0
75、下列物质中,只能由单质直接化合而制得的是
A.FeCl3 B.CuS C.Al2S3 D.FeS
76、下列物质属于纯净物的是
A.铝热剂 B.水泥
C.明矾 D.氯水
77、将热的铁片分别放入下列足量的溶液中,使溶液质量减轻的有
A.浓HNO3 B.AgNO3 C.FeCl3 D.稀H2SO4
78、Fe与稀HNO3反应时,若两者消耗物质的量之比为4∶10,且生成![]() ,则反应中生成的还原产物可能是
,则反应中生成的还原产物可能是
A.N2 B.N2O C.NO D.NH4NO3
79、由于易被氧化而不能长期存放在敞口容器中的是
A.NaOH晶体 B.绿矾
C.浓H2SO4 D.浓HCl
80、欲分离![]() ,加入试剂的顺序正确的是
,加入试剂的顺序正确的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
81、下列溶液中,通入H2S后不产生沉淀的是
A.FeCl2 B.FeCl3 C.H2SO3 D.CuSO4
82、下列试剂中能用来鉴别Al3+和Fe3+的是
A.KSCN B.FeCl3 C.H2SO3 D.CuSO4
83、根据如下反应:![]() 判断
判断![]() 氧化性强弱的顺序是
氧化性强弱的顺序是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
84、酸溶液中含有大量Fe2+和Ba2+,与之共存的阴离子是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
85、关铁与水反应的说法中正确的是
A.在任何条件下,铁与水均不发生反应。
B.在高温时,铁与水蒸气反应生成氢氧化铁和氢气。
C.在高温时,铁与水蒸气反应生成氧化铁和氢气。
D.在高温时,铁与水蒸气反应生成四氧化三铁和氢气。
86、跟27克Al反应相应的稀HNO3溶液中最多可溶解Fe的质量为
A.28g B.56g C.84g D.27g
87、下列离子在同一溶液中能大量共存的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
88、下列各组物质进行反应时,HNO3既表现出氧化性,又表现出酸性的是
①Fe2O3与HNO3; ②Fe与HNO3; ③H2S与HNO3;
④Cu2S与HNO3; ⑤C与HNO3
A.①与② B.②与③ C.②与④ D.③与④
89、在盐酸中加入铁粉,等铁粉全部溶解之后,再加入酸性KMnO4溶液,KMnO4溶液褪色其原因是
A.Fe有还原性 B.盐酸有还原性
C.KMnO4具有氧化性 D.FeCl2中Fe2+具有还原性
90、5.6g铁粉加入含0.3mol![]() 的溶液中,充分反应后,下列说法中正确的是
的溶液中,充分反应后,下列说法中正确的是
A.Fe全部被氧化 B.Fe部分被氧化
C.Fe3+全部被还原 D.Fe3+部分被还原
91、列说法正确的是( )
A.原电池是把电能转化为化学能的装置
B.原电池中电子流出的一极是正极发生氧化反应
C.原电池的两极发生的反应均为氧化还原反应
D.形成原电池后,原电池中的阳离子向正极移动
92、a、b、c、d四块金属板浸入稀H2SO4中,用导线两两相连,可以形成原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c极上产生大量气泡,b、d相连时,b极上有大量气泡。则四块金属的活动顺序是:( )
A.a>c>d>b B.c>a>b>d
C. a>c>b>d D.c>a>d>b
93、列各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是:( )
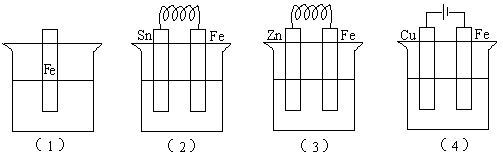
A.(4)>(2)>(1)>(3) B.(2)>(1)>(3)>(4)
C.(4)>(2)>(3)>(1) D.(3)>(2)>(4)>(1)
94、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2![]() Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
95、X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀H2SO4中时,X溶解,Z极上有H2放出。若电解Y2+和Z2+离子共存的溶液时,Y先析出。又知M2+离子的氧化性强于Y2+离子,则这四种金属的活动性由强到弱的顺序为( )
A.X > Z > Y > M B.X > Y > Z > M
C.M > Z > X >Y D.X > Z > M > Y
化学平衡
96、Cl2通入水中发生如下反应:Cl2+H2O ![]() HCl+HClO,欲增大所得溶液中HClO的浓度,应采取的措施为
HCl+HClO,欲增大所得溶液中HClO的浓度,应采取的措施为
A.加Na2CO3固体 B.加NaOH固体 C.加水 D.通入NH3气
97、将固体NH4I置于密闭容器中,在某温度下发生下列反应:①HN4I(固)![]() NH3(气)
NH3(气)
+HI(气);②2HI(气)![]() H2(气)+I2(气)。当反应达到平衡时,(H2)=0.5
mol·L-1,(HI)= 4 mol·L-1,则NH3的浓度为
H2(气)+I2(气)。当反应达到平衡时,(H2)=0.5
mol·L-1,(HI)= 4 mol·L-1,则NH3的浓度为
A.3.5 mol·L-1 B.4 mol·L-1
C.4.5 mol·L-1 D.5 mol·L-1
98、在一个固定体积的密闭容器中,放入3LX(气)和2LY(气),在一定条件下发生下列反应:4X(气)+3Y(气)![]() 2Q(气)+nR(气),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小
2Q(气)+nR(气),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小![]() ,则该反应方程式中的n值是
,则该反应方程式中的n值是
A.3 B.4 C.5 D.6
99、对于平衡体系xA(气)+ yB (固)![]()
![]() (气)+
(气)+![]() (气),其它条件不变,增大压强,C的百分含量减少,则明下列关系中正确的是
(气),其它条件不变,增大压强,C的百分含量减少,则明下列关系中正确的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
|
|
100、在一密闭容器中充入NO2,在一定条件下进行反应:2NO2![]() 2NO+O2。达到平衡状态的标志是
2NO+O2。达到平衡状态的标志是
A.NO2的消耗速率与NO的生成速率相等
B.容器内压强不随时间变化而变化
C.NO2和O2的消耗速率之比为2∶1
D.单位时间内生成2n mol NO。同时生成n mol O2
101、对可逆反应:A(气) + B(气)![]() 2C(气) + Q,根据右图,从a反应历程改变为b反应历程,所采取的措施是
2C(气) + Q,根据右图,从a反应历程改变为b反应历程,所采取的措施是
A.增大B的浓度 B.升高温度
C.加入催化剂 D.增大压强
102、X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应
X+2Y![]() 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)==n(Z),则Y的转化率为
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)==n(Z),则Y的转化率为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
103、反应2A(气)+3B(气)![]() xC(气)+y D(气),已知起始浓度A为5 mol·L-1,B为3 mol·L-1;C的反应速率为0.5 mol·min-1 ;反应开始至平衡需2分种;平衡时D的浓度为0.5 mol·L-1。下列说法正确的是
xC(气)+y D(气),已知起始浓度A为5 mol·L-1,B为3 mol·L-1;C的反应速率为0.5 mol·min-1 ;反应开始至平衡需2分种;平衡时D的浓度为0.5 mol·L-1。下列说法正确的是
A.(A)平∶(B)平=5∶3 B.A的转化率为20%
C.![]() =2∶1 D.D的反应速率为0.25 mol·L-1·min-1
=2∶1 D.D的反应速率为0.25 mol·L-1·min-1
104、符合右图的反应是
A.X +3Y![]() 2Z-Q
2Z-Q 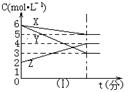
B.X + 2Y![]() 3Z + Q C.5X + 3Y
3Z + Q C.5X + 3Y![]() 4Z+ Q D.X + 3Y
4Z+ Q D.X + 3Y![]() 2Z + Q
2Z + Q
105、已知![]() 。若反应速率分别用
。若反应速率分别用![]()
(![]() )来表示,则正确的关系是
)来表示,则正确的关系是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
106、下列条件一定能使反应速率加快的是
①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物
⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
107.在一定条件下,在体积为VL的密闭容器中发生反应:mA
+ nB ![]() pC。t秒末,A减少了1 mol,B减少了1.25 mol,C增加了0.5 mol。则m ∶ n ∶ p应为
pC。t秒末,A减少了1 mol,B减少了1.25 mol,C增加了0.5 mol。则m ∶ n ∶ p应为
A.4∶ 5∶ 2 B.2∶ 5∶ 4
C.1∶ 3∶ 2 D.3∶ 2∶ 1
108.反应:A ![]() 2B中,A、B的浓度变化如图所示。则反应的速率为
2B中,A、B的浓度变化如图所示。则反应的速率为
|
|
A.![]() = 9
= 9![]() B.
B.![]() = 4.5
= 4.5![]()
C.![]() = 18
= 18![]() D.
D.![]() = 9
= 9![]()
109.在其它条件不变时,10℃时以某物质表示的反应速率为3![]() ,已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为:
,已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为:
A.48![]() ·S-1 B.36
·S-1 B.36![]() ·S-1
·S-1
C.24![]() ·S-1 D.12
·S-1 D.12![]() ·S-1
·S-1
电离平衡
110.下列说法中,正确的是
A.酸式盐的溶液一定显碱性
B.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为氢离子浓度和氢氧根离子浓度相等
D.碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的二倍
111.取同体积的pH = 2的盐酸和醋酸,分别稀释10倍,下列叙述中正确的是
A.稀释后盐酸的pH大于醋酸溶液的pH
B.稀释后的两种酸溶液分别与等物质的量(为过量)的碳酸钠粉末反应,在同温同 压下,醋酸产生的二氧化碳的体积大。
C.稀释后的两溶液分别与同浓度的氢氧化钠溶液反应时,消耗氢氧化钠化钠溶液的 体积相同
D.稀释后两溶液的pH分别均为3
112.25℃时,0.1![]() 的某一元弱酸溶液达到电离平衡后,测得其电离度为0.01%,下列说法正确的是
的某一元弱酸溶液达到电离平衡后,测得其电离度为0.01%,下列说法正确的是
A.将溶液稀释,电离度和溶液的pH都将增大
B.平衡时溶液的pH = 4
C.平衡时酸电离出的[H+]是水电离出的[H+]的104倍
D.若加入pH = 9的等体积的NaOH溶液,所得溶液的pH > 7
113.一种一元强酸HA的水溶液在加入一定量的碱MOH溶液后,溶液呈中性。下列判断中正确的是
A.加入的碱过量 B.反应后溶液中[A-] = [M+]
C.生成的盐不水解 D.酸与碱等物质的量混合
114.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是
A.Na+ Ba2+ Cl- SO42- B.K+ AlO2- NO3- OH-
C.H+ NH4+ Al3+ SO42- D.H+ Cl- CH3COO- NO3-
115.将0.2![]() 的CH3COONa溶液与0.1
的CH3COONa溶液与0.1![]() 的HCl溶液等体积混合后,溶液中下列微粒的物质的量浓度的关系中,正确的是
的HCl溶液等体积混合后,溶液中下列微粒的物质的量浓度的关系中,正确的是
A.[CH3COO-] = [Cl-] = [H+] > [CH3COOH]
B.[CH3COO-] = [[Cl-] > [CH3COO-] > [H+]
C.[CH3COO-] > [Cl-] > [H+] > [ CH3COOH]
D.[CH3COO-] > [Cl-] > [ CH3COOH] > [H+]
116.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A.HX、HZ、HY B.HZ、HY、HX
C.HX、HY、HZ D.HY、HZ、HX
117、物质的量浓度相等的下列溶液,pH值由大到小的顺序为:( )
A.Na2CO3、NaHCO3、NaCl、NH4Cl B.Na2CO3、NaHCO3、NH4Cl、NaCl
C.Na2CO3、NaCl、 NaHCO3、NH4Cl D.NaHCO3、Na2CO3、NaCl、NH4Cl
118、将10毫升0.1 mol/L氨水与6毫升0.2 mol/L盐酸混合反应后,溶液中离子浓度关系正确的是:( )
A.[Cl-]![]() [NH4+]
[NH4+]![]() [OH-]
[OH-]![]() [H+] B.[NH4+]
[H+] B.[NH4+]![]() [Cl-]
[Cl-]![]() [H+]
[H+]![]() [OH-]
[OH-]
C.[Cl-]![]() [NH4+]
[NH4+]![]() [H+]
[H+]![]() [OH-] D.[H+]
[OH-] D.[H+]![]() [Cl-]
[Cl-]![]() [NH4+]
[NH4+]![]() [OH-]
[OH-]
119、下列物质溶于水,由于水解而使溶液呈酸性的是( )
A.P2O5 B.NaHSO4 C.NaF D.CuCl2
120、证明氨水是弱碱的事实是( )
A.氨水与硫酸发生中和反应。
B.氨水能使紫色石蕊液变蓝。
C.0.1 mol/L的NH4Cl溶液的pH值为5.1。
D.铵盐与熟石灰反应逸出氨气。
121、下列各组离子,在水溶液中能以较高浓度大量共存的是( )
①I-、ClO-、NO![]() 、H+ ②K+、NH
、H+ ②K+、NH![]() 、HCO
、HCO![]() 、OH-
、OH-
③SO![]() 、SO
、SO![]() 、Cl-、OH- ④Fe3+、Cu2+、SO
、Cl-、OH- ④Fe3+、Cu2+、SO![]() 、Cl-
、Cl-
⑤H+、K+、AlO![]() 、HSO
、HSO![]() ⑥Ca2+、Na+、SO
⑥Ca2+、Na+、SO![]() 、CO
、CO![]()
A.①⑥ B.③④ C.②⑤ D.①④
122、等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液完全反应后,溶液中有关离
子浓度之间不存在的关系是( )
A.[H+]·[OH-]=K![]() B.[Na+]=[CH3COO-]+[OH-]
B.[Na+]=[CH3COO-]+[OH-]
C.[Na+]+[H+]=[CO3COO-] +[OH-] D.[Na+]>[CH3COO-]> [OH-]> [H+]
123、下列溶液①pH=0的盐酸,②0.5 mol/L HCl溶液,③0.1 mol/L的NH4Cl溶液,④0.1
mol/L的NaOH,⑤0.5 mol/L CH3COONa溶液,这五种溶液中由水本身电离的[H+]
由大到小的顺序正确的是( )
A.①②③④⑤ B.③⑤④②① C.①②③⑤④ D.⑤③④①②
124、下列离子方程式正确的是( )
A.硫化钠溶液呈碱性:S2-+H2O = HS-+OH-
B.硫酸铝溶液呈酸性:Al3++3H2O = Al(OH)3¯+3H![]()
C.FeCl3溶液和Na2CO3溶液混合:2Fe3++3CO![]() +3H2O = 2Fe(OH)3¯+3CO2
+3H2O = 2Fe(OH)3¯+3CO2
D.在NH4Cl溶液中撒入镁粉后加热:2NH4++Mg![]() Mg2++2NH3+H2
Mg2++2NH3+H2
125、一种[H+]=1×10-3 mol/L的酸溶液和一种[OH-]=1×10![]() mol/L的碱溶液等体积混合后溶液呈碱性,其原因可能是( )
mol/L的碱溶液等体积混合后溶液呈碱性,其原因可能是( )
A.浓的强碱溶液和稀的强酸溶液反应。
B.浓的弱碱溶液和稀的强酸溶液反应。
C.等浓度的强碱和弱酸溶液反应。
D.生成一种强碱弱酸盐。
126、在pH=1的无色透明溶液中,因发生氧化还原反应不能共存的离子组是( )
A.Fe3+、Cu2+、Cl-、NO3- B.Na+、K+、SO![]() 、AlO2-
、AlO2-
C.Mg2+、NH4+、SO![]() 、CO
、CO![]() D.S2-、Cl-、NO
D.S2-、Cl-、NO![]() 、NH4+
、NH4+
127、下列说法中正确的是:
A.在磷酸钠溶液中![]()
B.pH=10的NaOH 溶液加水稀释100倍,溶液的pH=12
C.0.3![]() 的CH3COOH溶液中的[H+]是0.1
的CH3COOH溶液中的[H+]是0.1![]() CH3COOH溶液中[H+]
CH3COOH溶液中[H+]
的3倍
D.100℃时,纯水的pH=6,它显中性
128、25 mL pH=10的KOH溶液跟50 mL pH=10的Ba(OH)2溶液混合,混合溶液的pH是:
A.9.7 B.10 C.10.3 D.10.7
129、将体积都为10mL、pH都等于3的醋酸和盐酸,加水稀释至a ml和b ml,测得稀释后溶液的pH均为5。则稀释后溶液的体积:
A.![]() B.
B.![]()
C.a < b D.a > b
130、在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是:
A.pH = 3的硝酸跟pH = 11的氢氧化钾溶液
B.pH = 3的盐酸跟pH = 11的氨水
C.pH = 3的硫酸跟pH = 11的氢氧化钠溶液
D.pH =3的醋酸跟pH = 11的氢氧化钡溶液
131、在水电离出的![]()
![]() 的溶液中,能大量共存的离子组是:
的溶液中,能大量共存的离子组是:
A.![]() B.
B.![]()
C.![]() D.
D.![]()
132、硫化氢水溶液中有如下动态平衡关系:H2S![]() H++HS-,HS-
H++HS-,HS-![]() H+
+ S2-, H2O
H+
+ S2-, H2O![]() H+
+ OH-。在稀氢硫酸溶液中,下列各关系正确的是:
H+
+ OH-。在稀氢硫酸溶液中,下列各关系正确的是:
A.![]()
B.![]()
C.![]()
D.![]()
133、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测定结果偏高的是:
①用天平称量NaOH固体时,将NaOH放在右盘,砝码放在左盘,并移动游码使之平衡。②配制NaOH溶液时,将称量的NaOH固体溶于水后立即移入容量瓶,并加蒸馏水至刻度线。③用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定。④用蒸馏水洗净酸滴定管后盛入标准盐酸进行滴定。⑤滴定终点读取酸滴定管数据时,仰视刻度线。
A.①⑤ B.②④⑤ C.②③④⑤ D.①②③④⑤
答案:
1.B2.C3.BC4.AB5.D6.D7.A8.D9.A10.D11.C12.AC13.B14.B15.A16.C17.D 18.C19.A20.A21.D22.A23.B24.C25.B26.B27.C28.D29.A30.B31.D32.D33.B 34.AD35.B36.AD37.Ac38.D39.C40.D41.A*41.BD42.B43.C44.Ac
45.D46.AD47.D48.C49.B50.A51.D52.CD53.A54.AB55.C56.A57.C58.B 59.BC60.D61.A62.AC63.C64.A65.C66.B67.D68.CD69.D70.B71.C72.C 73.CD74.D75.C76.C77.B78.BD79.B80.A81.A82.A83.D84.C85.D86.C87.D88.C89.CD90.AD91.AD92.A93.B94.D95.B96.A97.D98.D99.C100.BC 101.A102.B103.CD104.D105.D106.C107.A108.BD109.A110.C111.AB
112.A113B114.B115.D116.C117.A118.C119.D120.C121.B122.B123.B124.CD125.B126.D127.D128.B129.D130.D131.B132.A133.B