高二化学(上)第四次月考
相对原子质量:H-1 O-16 N-14 Mg-24 Al-27 Fe-56
将答案一律填在答案卷
第Ⅰ卷(选择题 共78分)
一.选择题: (单选)
1.已知空气—锌电池的电极反应为:
锌片:2Zn+4OH--4e-=2ZnO+2H2O
碳棒: O2+2H2O+4e-=4OH-
据此判断,锌片是
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
2.与酸碱都能反应的离子是
A.Al3+ B.Fe3+ C.AlO2- D.HCO3-
3. 下列关于Al(OH)3的性质叙述中错误的是
A. Al(OH)3与过量的浓氨水反应生成NH4AlO2
B. Al(OH)3是难溶于水的白色胶状物质
C. Al(OH)3能凝聚水中的悬浮物,还能吸附色素
D. Al(OH)3受热能分解
4.铁片放入下列溶液中,铁片溶解且固体的总质量增加的是
A.稀H2SO4 B. CuSO4 C. Na2SO4 D. 浓H2SO4
5.下列反应中,有单质铁生成的是
A. Cu+FeCl3 (aq) B. Na + FeSO4 (aq)
C. Al + Fe3O4(高温) D. Ag + FeSO4 (aq)
6.工业上常用Fe2O3 和CO反应冶炼铁,该反应中
A.氧化剂是CO B.氧化剂是Fe2O3 C.氧化剂是Fe D. 还原剂是CO2
7.正在燃烧的镁条,放入下列气体中,不能继续燃烧的是
A.CO2 B.Cl2 C.He D.O2
8.在下列常见的金属中,属于重金属的是
A.钾 B.镁 C.铝 D.铜
二.选择题(单选或双选)
9.冶炼K、Ca、Na、Al等活泼金属通常采用的方法是
A.热分解法 B.热还原法
C.电解其熔融盐或氧化物 D.电解其盐的水溶液
10.将Zn片和Cu片用导线连接于同一稀H2SO4中,下列叙述中正确的是
A.Cu片不断溶解 B.Cu片上有气泡产生
C.溶液中H+从Cu片获得电子 D.Zn片上有Cu析出
11.下列物质的溶液在一定条件下能跟某些金属单质,非金属单质、酸、碱均发生反应的是
A.FeCl2 B.Fe2O3 C.HCl D.NaHCO3
12.下列各组金属均应用电解法冶炼的是
A.Ca、Mg B.Al、Fe C.Fe、Cu D.Hg、Ag
13.下列各组物质反应后,再滴入KSCN溶液,显红色的是
A.过量铁与稀盐酸 B.过量氯水与FeCl2溶液
C.过量铁粉与CuCl2溶液 D.过量铁粉与FeCl3溶液
14.下列装置中,能组成原电池的是
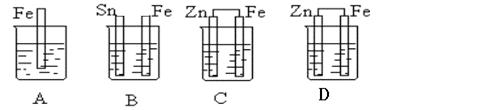
(A中CuSO4溶液 B中稀硫酸 C中稀硫酸 D中酒精)
15.下列叙述中,能表明金属甲比金属乙活动性强的是
A.在氧化还原反应中,甲比乙失电子多
B.同价态阳离子,甲比乙的氧化性强
C.甲、乙都能与稀盐酸反应生成氢气
D. 将甲、乙组成原电池时,甲为负极
16.在强酸性溶液中,能大量共存的离子组是
A. Mg2+ Al3+ SO42- NO3- B. Na+ Ba2+ AlO2- Cl-
C. HCO3- Mg2+ K+ Cl- D. Cu2+ Al3+ Cl- SO42-
17. 两块铝片,一块与盐酸反应,另一块与NaOH溶液反应,在相同状况下产生H2的体积比为1∶2。则这两块铝片的质量比为
A. 1∶1 B.1∶2 C. 1∶3 D.2∶1
18.在相同条件下,一定量的镁、铝、铁分别投入到等体积等物质的量浓度且均过量的稀硫酸中,充分反应,三溶液质量仍相等,则镁铝铁的质量关系是
A.相等 B.Mg>Al>Fe C.Mg<Al<Fe D.Al>Mg>Fe
第Ⅱ卷(非选择题 共78分)
三、填空题:
19. Fe与Cl2 反应生成 ,Fe与S 反应生成 。从这两个反应的生产物中铁元素的化合价不同,可以推出Cl2 的氧化性比S的氧化性 。
20.按要求写出下列反应方程式:
⑴Al3+ →Al(OH)3 离子反应方程式 :
⑵Fe3+→Fe2+离子反应方程式 :
⑶红热的铁与水蒸气反应
⑷用三氧化钨冶炼钨
21.炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便出现红色锈斑[该锈班为Fe(OH)3],试用有关电极反应式,离子方程式和化学方程式表示Fe(OH)3的形成过程。
(1)负极:
(2)正极:
(3):溶液中的化学方程式(能写出离子方程式的写离子方程式)
① ②
22.新制备的Al2O3既能跟强酸稀硫酸反应生成 盐(填化学式),反应的离子方程式是 。又能跟强碱氢氧化钠反应生成 盐(填化学式),反应的离子方程式是 。所以Al2O3是 性氧化物。用Al2O3为原料冶炼金属铝的化学方程式为 。
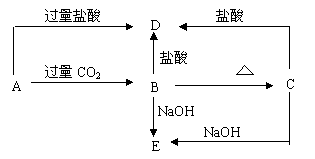 23.已知A为澄清溶液,焰色反应为浅紫色,C难溶于水
23.已知A为澄清溶液,焰色反应为浅紫色,C难溶于水
试推断(写化学式):A B C
D E
四.计算题:
24.用铜片、锌片和稀H2SO4 组成原电池,若铜片上共放出4.48L气体(标准状况)时,H2SO4恰好全部作用完。试计算:
⑴产生这些气体所消耗的锌的质量。
⑵产生这些气体时,通过导线的电子的数目。
25.100mL0.6mol/LAlCl3溶液中加入300mL0.7mol/LNaOH溶液,求生成沉淀的质量。
26.将1.4g纯铁粉放入80ml 1 mol/L的稀HNO3 中,反应停止后,生成的硝酸盐的成分什么?其质量是多少?被还原的硝酸质量又是多少?
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
高二(上)第二次月考
化学(答案卷)
班级 姓名 得分
一,二.选择题
19.
20.(1)
(2)
(3)
(4)
21.(1)
(2)
(3)①
②
22.
23.A B C
D E
24.
25.
26.