长郡中学高二年级2006年下学期段考
化 学 试 卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
可能用到的相对原子质量:H-1,O-16,N-14,Ca-40,C-12,Cu-64,S-32,Ba-137
第Ⅰ卷
一、选择题(本题包括16小题,共48分).每小题只有一个选项符合题意,请将正确答案的序号填入答卷栏。
![]() 1.可逆反应A(g)+3B(g)
2C(g)+2D(g),在不同条件下的反应速率如下,其中反应最快的是
1.可逆反应A(g)+3B(g)
2C(g)+2D(g),在不同条件下的反应速率如下,其中反应最快的是
A.vA=0.5mol/ (L·s) B.vB =0.6mol/ ( L·s)
C.vc=0.4mol/ ( L·s) D.vD=0.45mol/ (L·s)
2.在0.01mol/L硫酸溶液中,水电离出的H+浓度是
A.1×10-12mol/L B.0.02mol/L
C.1×10-7mol/L D.5×10-13mol/L
3.下列说法中正确的是
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态
D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
![]() 4.右图表示可逆反应A(g)+B(g)
nC(g)(正反应为放热反应),在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是
4.右图表示可逆反应A(g)+B(g)
nC(g)(正反应为放热反应),在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是
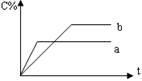 A.a表示有催化剂,而b无催化剂
A.a表示有催化剂,而b无催化剂
B.若其他条件相同,b比a的温度高
C.若其他条件相同,a比b的压强大,n>2
D.反应由逆反应方向开始
5.将pH=1的某酸溶液和pH=13的某碱溶液等体积混合后,所得溶液中pH
A.大于7 B.小于7
C.等于7 D.以上都有可能
6.关于小苏打水溶液的表述正确的是 A.c(Na+)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)
)+c(H2CO3)
B.c(Na+)+c(H+)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(OH-)
)+c(OH-)
C.HCO![]() 的电离程度大于HCO
的电离程度大于HCO![]() 的水解程度
的水解程度
D.存在的电离有:NaHCO3= Na++HCO![]() ,HCO
,HCO![]() =H++ CO
=H++ CO![]()
7.合成氨所需的氢气可由水煤气反应制得,其中一步反应为CO(g)+ H2O(g) ![]() CO2(g)+H2(g) (正反应为放热反应),下列措施中能提高CO转化率的是
CO2(g)+H2(g) (正反应为放热反应),下列措施中能提高CO转化率的是
A.增大压强
B.升高温度
C.增大水蒸气的浓度 D.增大CO的浓度
8.下列叙述正确的是
A.pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
9.物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
10.下列事实不能用勒夏特列原理来解释的是
A.光照新制的氯水时,溶液中酸性逐渐增强
B.加催化剂使N2和H2在一定条件下转化为NH3
C.增大压强,有利于SO2和O2反应生成SO3
![]() D.在Fe3++3KSCN Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
D.在Fe3++3KSCN Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
![]() 11.将2molSO2,
1molO2充入带活塞的密闭容器中,发生反应2SO2(g)+ O2(g) 2 SO3(g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是
11.将2molSO2,
1molO2充入带活塞的密闭容器中,发生反应2SO2(g)+ O2(g) 2 SO3(g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是
A.保持温度和容器的压强不变,充入1mol SO3(g)
B.保持温度和容器的容积不变,充入1mol SO3(g)
C.保持温度和容器的压强不变,充入1mol O2(g)
D.保持温度和容器的压强不变,充入1mol Ar(g)
12.已知常温(25℃)时pH+pOH=14,室温时pH为10的NaOH溶液加热后所得溶液的pOH是
A.大于4 B.小于4
C.等于4 D.无法判断

![]() 13.在密闭容器中,一定条件下进行反应:mA (气)
+ nB (气) pC (气) + qD (气)若增大压强,或升高温度,重新达到平衡,
13.在密闭容器中,一定条件下进行反应:mA (气)
+ nB (气) pC (气) + qD (气)若增大压强,或升高温度,重新达到平衡,![]() 、
、![]() 随时间化过程均如下图所示,则对该反应叙述正确的是
随时间化过程均如下图所示,则对该反应叙述正确的是
A.正反应是放热反应,![]()
B.逆反应是放热反应,![]()
C.正反应是放热反应,![]()
D.逆反应是放热反应,![]()
14.在一个不传热的固定容积的密闭反应器中,可逆反应mA(g)+nB(g) ![]() pC(g)+qD(g),当m、n、p、q为任意正整数时,达到平衡的标志是
pC(g)+qD(g),当m、n、p、q为任意正整数时,达到平衡的标志是
①体系的压强不再发生改变 ②体系的温度不再发生改变
③各组分的物质的量浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率:V(A):V(B):V(C):V(D)=m:n:p:q
⑥单位时间内,若消耗了m mol A物质,同时也消耗了q mol D物质
A.①③⑤ B.①④⑥
C.②③④⑥ D.①②③④⑤⑥
15.在一密闭容器中,等物质的量的A和B发生如下反应:A(g)+2B(g)
![]() 2C(g),反应达到平衡状态时,若混和气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 A.40% B.50%
2C(g),反应达到平衡状态时,若混和气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 A.40% B.50%
C.60% D.70%
16.下列混合液中,各离子浓度的大小顺序正确的是
A.10ml0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)>c(C1—)>c(OH—)>c(H+)
B.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,
c(Cl—)>c(NH4+)>c(OH—)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与10mL0.1moL/LNaOH溶液混合,
c(Na+)>c(CH3COO-)>c(OH—)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mLlmoL/L盐酸混合,
c(Cl—)>c(Na+)>c(OH—)>c(H+)
长郡中学高二年级2006年下学期段考化学试卷
 答
卷
答
卷
第Ⅰ卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第II卷(非选择题,共52分)
二、填空题(本大题包括4小题,共24分)
17.(4分)工业上合成氨的反应为N2(g)+3H2(g) ![]() 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)使用催化剂是为了__________ _____;
(2)通常采用20MPa—50MPa的压强,原因是____________________ __ 。
18.(6分)将足量的锌分别加入pH相同、溶液体积也相同的两种酸溶液(甲:盐酸,乙:醋酸)中,比较下列情况中甲与乙的大小(均选用“<”、“=”或“>”填空):
(1)反应刚开始时的反应速率甲 乙;
(2)反应进行到5s时的反应速率甲 乙;
(3)反应完全后产生氢气的质量甲 乙。
19.(6分)在亚硫酸氢钠溶液中,既存在 HSO3-
的电离平衡: HSO3- ![]()
H++SO32- ,也存在 HSO3-
的水解平衡,其水解离子方程式
。
H++SO32- ,也存在 HSO3-
的水解平衡,其水解离子方程式
。
(1)已知在 0.1mol·L-1 的 NaHSO3 溶液中有关微粒浓度由大到小的顺序为: c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) 。则该溶液中 c(H+) c(OH-) (填“ < ”“ > ”“ = ”);
(2)现向 NH4HSO3 溶液中,逐滴加入少量含有酚酞的氢氧化钠溶液,可观察到的现象是溶液的红色褪去,溶液呈无色,试写出该反应的离子方程式:
_____
____________ 。
| 座位号 |
 20.(8分)右图中A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。
20.(8分)右图中A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。
(已知:2NO2 ![]() N2O4;正反应为放热反应)
N2O4;正反应为放热反应)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变);
(2)若在A、B中再充人等量的Ne气,则达到平衡时,A中NO2的转化率将_________B中NO2的转化率 (填“>”、“<”、“=”、“无法确定”);
(3)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________。
三、实验题(本大题包括2小题,共16分)
21.(4分).现有如下药品和仪器:冰醋酸,蒸馏水、pH试纸、烧杯、玻璃棒、量筒等,某同学利用它们设计实验证明CH3COOH为弱酸。请回答下列问题:
(1)需要记录的数据是 ;
(2)用pH试纸测定无色溶液的pH时,规范的操作是:
。
22.(12分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量测量的实验步骤如下(为保证准确度,要做两次实验):
①需配制0.1 mol·L-1 的盐酸和0.1mol·L-1 的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol·L-1 的氢氧化钠溶液滴定,需用去VmL(两次的平均值)达滴定终点;
④加入25.00mL0.1mol·L-1 的盐酸溶液。
(1)上述实验步骤中正确的操作顺序是(写编号顺序,必要时可重复)______________。
(2)如图所示的仪器中配制0.1mol·L-1 盐酸溶液和0.1mol·L-1 氢氧化钠溶液肯定不需要的仪器是(填序号)___________,配制上述溶液还需要的玻璃仪器是(填仪器名称)_____________。
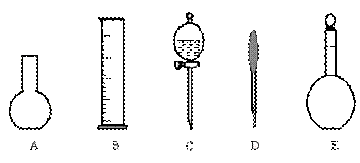 |
(3)配制上述溶液应选用的容量瓶的规格是(填字母)__________________。
(A)50mL、50mL (B)100mL、100mL
(C)100mL、150mL (D)250mL、250mL
(4)写出有关的化学方程式____
。
(5)一粒胃药中含碳酸钙的质量是(写表达式)____________________________________。
四、计算题(本题包括2小题,共12分)
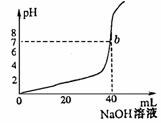 23.(4分)下图是用0.1mol/LNaOH溶液中和某浓度H2SO4溶液时,溶液的pH值变化的曲线。依此求:
23.(4分)下图是用0.1mol/LNaOH溶液中和某浓度H2SO4溶液时,溶液的pH值变化的曲线。依此求:
(1)H2SO4溶液的物质的量浓度 。
(2)滴定到![]() 点,溶液的总体积约为
点,溶液的总体积约为
![]() 。
。
24.(8分)有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量的BaCl2溶液,过滤、洗涤、烘干后得到9.32g沉淀,滤液跟4mol/LNaOH溶液反应,用去25mL碱液时恰好中和。
(1)求混合溶液中硫酸和硝酸的物质的量浓度。
(2)另取10mL原混合溶液,加入3.2gCu粉共热,在标准状况下可收集到多少毫升气体?
长郡中学高二年级2006年下学期段考化学试卷
答 案
第Ⅰ卷(48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | D | D | C | D | A | C | D | C | B | A | C | A | C | A | C |
第II卷(非选择题,共52分)
17——23题每空2分
17(4分).提高反应速率;从化学平衡考虑,应采用高压,(1分)从动力、设备考虑应该采用常压;(1分)(其他合理答案均可)
18.(6分)= 、 < 、 <
19.(6分)HSO3-+H2O
![]() H2SO3+OH- (1) > ,(2)HSO3-+OH-=SO32-+H2O
H2SO3+OH- (1) > ,(2)HSO3-+OH-=SO32-+H2O
20.(8分)(1)< 、变小 ; (2)无法确定 ; (3)0.02mol
21.(4分)(1)稀释的倍数和稀释前后的pH;(2)干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上(1分),跟标准比色卡比较(1分)。
22.(12分)每空2分
(1)①②④③②④③(或②①④③②④③)
(2)A、C(对一个给1分但错答不给分); 玻璃棒、烧杯(对一个给1分但错答不给分)(3)B (4)CaCO3+2HCl=CaCl2+CO2↑+H2O(1分)
HCl+NaOH=NaCl+H2O(1分)
(5)[2.5×10-3-1×10-4V]×50g(合理即可)
23.(4分)(1)![]() (2)44
(2)44
24.(共8分,每小题4分)(1)c(H2SO4)=4mol/L c(HNO3)=2mol/L
(2)448mL(判断出Cu及H+过量给2分)