八校联合体第一次联考
高 二 年 级 化 学 试 卷
出卷人:卞玉牛 审核人:芮先华
有关参考数据:原子量 O 16;C 12;N 14;H 1。
第一卷
一、 选择题(每小题只有一个正确答案;每小题4分)
1、下列物质在空气中加热,能升华的是( )
A、红磷 B、碘
C、氯化铵 D、硝酸铵
2、氨水中存在的微粒有( )
A、两种 B、四种 C、五种 D、六种
3、稀硫酸溶液中插入一块铜片,加入下列哪一种物质以后,铜片腐蚀最快的是( )
A、稀盐酸 B、KCl晶体 C、KNO3晶体 D、Na2SO4晶体
4、某温度下, pH=10的氢氧化钠溶液水电离出的c(OH-)为( )
A、10-4 mol/L B、10-7 mol/L C、10-10mol/L D、10-5 mol/L
5、下列溶液肯定是酸性的是( )
A、 含H+的溶液 B 、加酚酞显无色的溶液
C 、pH<7的溶液 D 、c(OH-)<c(H+)的溶液
6、下列各溶液中pH最大的是( )
A、 pH=9的氨水稀释1000倍
B、 pH=5的盐酸稀释1000倍
C、 pH=9的烧碱溶液稀释1000倍
D、 pH=4的醋酸和pH=10的烧碱溶液等体积混合
7、 氮族元素与碳族、氧族元素相比较,下列变化规律正确的是( )
A、 原子半径:C<N<O
B、非金属性:Si<P<O
C、还原性:SiH4 <PH3 <HCl
D、酸性:H2SiO3 >H3PO4 >H2SO4
8、 往纯水中加入下列物质,能使水的电离平衡发生移动的是( )
A、NaCl B、蔗糖 C、酒精 D、CH3COOH
二、选择题(每小题只有1~2个正确答案;正确答案,每小题4分;多选和错选不得分,少选得2分。)
9、相同条件下,体积不相同的三个烧瓶中分别盛满了NH3、HCl和NO2,将它们倒扣在水槽中充分溶解后,塞住瓶口取出(溶质不扩散到烧瓶外),则烧瓶内三种溶液的物质的量浓度之比为( )
A、1:1:1 B、2:2:3 C、3:3:2 D、无法判断
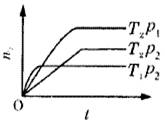 10、反应2X(g)+Y(g)
10、反应2X(g)+Y(g)![]() 2Z(g)(正反应放热),
在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。下述判断正确的是( )。
2Z(g)(正反应放热),
在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。下述判断正确的是( )。
A、T1<T2, p1<p2
B、T1<T2, p1>p2
C、T1>T2, p1>p2
D、T1>T2, p1<p2
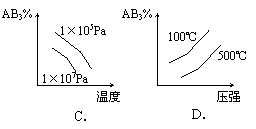
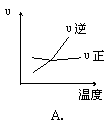
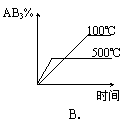
11、对于可逆反应 2AB3(g) ![]() A2(g) + 3B2(g) (正反应为吸热反应),下列图像正确的是( )
A2(g) + 3B2(g) (正反应为吸热反应),下列图像正确的是( )
 | |||||
 | |||||
 | |||||
12、一个装有10mlNO的试管倒立于盛有适量水的水槽中,向试管中通适量的氧气,充分反应后,试管中最后剩有2ml气体,则通入的氧气的体积可能为( )
A、6ml B、9.5ml C、4.5ml D、7.5ml
13、能把Na2SO4、NH4NO3、K NO3、(NH4)2SO4四瓶无色溶液加以区别(必要时可以加热)的一种试剂是( )
A、BaCl2 B、Ba(NO3)2 C、Ba(OH)2 D、AgNO3
14、30克铜金合金投入到一定量的浓硝酸中,当合金中的铜完全溶解时,生成气体的颜色越来越淡,共收集到气体6.72L,将盛此气体的容器倒扣在水中,通入3.36L标准状况下的氧气恰好使气体完全溶于水,则合金中铜的质量分数是( )
A、50% B、56% C、60% D、64%
15、在1L密闭容器中通入2mol氨气,在一定温度下发生反应;2NH3 ![]() N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )
N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )
A、3mol H2和1mol N2
B、2mol NH3和1mol N2
C、2mol N2和3mol H2
D、0.1mol NH3、0.95mol N2、2.85mol H2
16、一定温度下,可逆反应A2(g)+3B2(g) ![]() 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
( )
A.容器内每减少1mol A2,同时生成2mol AB3
B.容器内每减少1mol A2,同时生成3mol B2
C.容器内A2、B2、AB3的物质的量之比为1:3:2
D.容器内A2、B2、AB3的物质的量浓度之比为1:1:1
17、38.4毫克铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4毫升(标准状况),则反应消耗的硝酸的量可能是( )
A、1.0×10 -3摩尔 B、1.6×10 -3摩尔
C、2.2×10 -3摩尔 D、138.6毫克
18、用水稀释0.1mol/L的醋酸溶液,其中随水的增加而增大的有( )
① H+的物质的量 ② c(H+) ③ c(OH-) ④ c(H+)/c(CH3COOH)
⑤c(CH3COOH)/c(CH3COO-) ⑥ 溶液中的离子总数
A、①③④ B、①③⑤ C、②④⑥ D、①③④⑥
三、填空
19、(每空3分,共12分)如下图所示,实验室用NH4Cl和Ca(OH)2制取NH3 。试回答下列问题:
(1)B处的药品是
(2)用向下排空气法收集NH3时,C处棉花上应蘸取 。
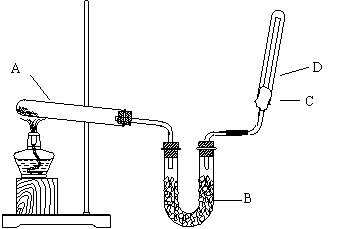
(3)试管A发生的化学方程式为 。
(4)在标准状况下,收集满一试管NH3后,将该试管放入水中(溶液不扩散到试管外),则最后所得溶液的物质的量浓度为 mol/L 。
20、(每空3分,共6分)工业尾气中含有各种氮的氧化物(主要是NO和NO2,表示为NOx), NOx是严重的大气污染物,处理这些废气的方法之一是通入适量的氨气,反应后会生成一种无色无味的气体。
(1)写出NOx与NH3反应的化学反应方程式:
。
(2)该方法的优点是: 。
四、填空
21.(每空2分,共14分)
在某温度下,A+B![]() 2C反应达到化学平衡。
2C反应达到化学平衡。
(1)升高温度时,C的物质的量浓度减小,则正反应是 热反应,(填吸或放), V(正) ,V(逆) (填增大或减小),平衡向 移动。
(2)若B为气态,增大压强平衡不发生移动,则A是 态,C是 态。
(3)若增加B的物质的量,平衡不发生移动,则B是 态。
22、(每空3分,共12分)在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)![]() 3Z(气),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
3Z(气),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入3 mol X和9mol Y,达到平衡后,Z的物质的量为 mol。
(2)在相同实验条件下,若在同一容器中改为加入2 mol X和10 mol Y,若要求在反应混合气体中Z体积分数不变,则加入的Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX, 则需加入 mol Y, mol Z,才能使平衡时Z为0.9a mol。
23、(每空2分,共6分)现有pH =1盐酸、硫酸、氢氟酸溶液,
(1)设三种溶液的物质的量浓度分别为a,b,c,则其关系为 ;
(2)完全中和体积和物质的量浓度都相同的NaOH 溶液时,需三种酸的体积分别为a,b,c,则其关系为 ;
(3)取等体积的三种酸溶液加入适量NaOH溶液,恰好完全中和,所得溶液的pH 分别为a,b,c,则其关系为 ;
|
|
 |
(1)甲是 ,乙是 ,丙是 。
(2)混合气体A的主要成份 。
(3)甲与乙反应的化学方程式 。
五、计算(25题6分,26题12分)
25、100℃时,水的离子积为1×10-12,在该温度下将pH=8的Ba(OH)2溶液与PH=4的稀硫酸溶液混合,欲使混合溶液的pH=7,则Ba(OH)2溶液与H2SO4溶液的体积比为多少?(假设二者混合后的体积为二者体积之和)
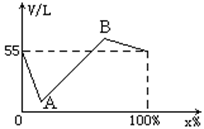
26、已知NH3和Cl2可快速反应: 2NH3+3Cl2=N2+6HCl,下图为反应后总体积(V L)随原混合气体中Cl2的体积分数(x%)而变化的曲线。试计算:
(1) 当反应结束时处于A、B两点时,原混合气中Cl2的体积分数各是
和 。
(2) 当反应结束时处于A、B两点,混合气的总体积各是 和 。
(3) 若反应结束时气体总体积为11L,则原混合物中Cl2的体积分数为 。
八校联合体第一次联考高二年级化学试卷答案
一、 选择题(每小题只有一个正确答案;每小题4分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | D | C | C | D | A | B | D |
二、 选择题(每小题只有1~2个正确答案;正确答案,每小题4分;多选和错选不得分,少选得2分。)
| 9 | 10 | 11 | 12 | 13 |
| A | C | BD | AB | C |
| 14 | 15 | 16 | 17 | 18 |
| D | AD | B | CD | D |
三、 填空
19、(1)碱石灰 (2) 水或稀硫酸
(3) 略
(4) 1/22.4 mol/L 。(每空3分)
20、(1)化学方程式 6NOx + 4x NH3 =(2x+3)N2 + 6x H2O 。
(2)优点: 产物没有污染,(1分)而且用一种物质就可以将氮的多种氧化物的污染消除,“广普高效” (2分)。
(每空3分)
21、(1) 放 , 增大 , 增大 , 逆
(2) 气 , 气
(3) 固体或纯液体 (每空2分)
22、(1) 3a (2) 12
(3) 1.9 , 1.2 (每空3分)
23、(1) b<a<c (2) a=b>c (3) a=b<c
(每空2分)
24、(1) 甲是C 乙是HNO3 丙是Cu
(2) CO2 , NO2
(3) C + 4HNO3 = CO2 ↑+ 4NO2 ↑+ 2H2O
五、计算
25、(本题6分)解:设体积分别为V1 、 V2
H2SO4 + Ba(OH)2 = 2H2O + BaSO4
根据题意,Ba(OH)2剩余 ……………………… 1分
反应后的溶液中
|
|
V1 + V2
V1/ V2=11/9………………………3分
26、(本题12分)
(1) 27.3% (2分) , 60% (2分)
(2) 5 (2分) , 77 (2分)
(3) 24% 或 30% (每个数据2分)