扬州市2003—2004学年度第二学期期末调研测试试题
高 二 化 学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试时间120分钟。
第Ⅰ卷(选择题 共72分)
可能用到的相对原子质量:
H:1;O:16;Na:23;C:12
一、选择题(本题包括8小题,每小题4分,共32分。每题只有一个选项符合题意)
1.我国科学家首次人工合成的蛋白质是( )
A.淀粉酶 B.蛋白酶 C.核酸酶 D.结晶牛胰岛素
2.下列化学式中,只能用来表示一种物质的是( )
A.C2H4Cl2 B.C5H12 C.C D.C2H5Cl
3.从石油分馏得到的固体石蜡(主要成分为烷烃),用氯气漂白后,燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过
A.加成反应 B.取代反应
C.聚合反应 D.裂化反应
4.下列物质①裂化汽油;②甘油;③天然油脂;④硬脂酸钠;⑤福尔马林;⑥苯酚;⑦聚氯乙烯;⑧银氨溶液。其中属于纯净物的是( )
A.②③⑤⑥⑦⑧ B.③⑤⑦⑧ C.②④⑥ D.②③④
5.“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出直径从几纳米至几十纳米的材料(1纳米=10—9米),若将纳米材料分散到分散剂中,所得到混合物具有的性质是( )
A.能全部透过半透膜 B.所得物质一定是浊液
C.所得液体一定是无色透明溶液 D.所得液体有丁达尔效应
6.下列有机物的命名正确的是( )
A. 2,2—二甲基丁烷. B.2,3,3—三甲基丁烷
C.2—乙基丁烷 D.3,3—二甲基丁烷
7.1g炭与适量的水蒸气反应生成CO和氢气,需要吸收10.9KJ的热量,则下列热化学方程式正确的是:
A.C+H2O=CO+H2;△H=+131.2KJ/mol
B.CO(g)+H2(g)=C(s)+H2O(g);△H= —131.2KJ/mol
C.C(s)+H2O(g)=CO(g)+H2(g);△H= +10.9KJ/mol
D.C(s)+H2O(g)=CO(g)+H2(g);△H= —131.2KJ/mol
8.某共价化合物分子中只含有C、N、H三种元素,且以n(C)、n(N)分别表示C、N的原子数目,则H原子数目最多是:
A.2 n(C)+n(N)+2 B.2 n(C)+ 2n (N)+2
C.3n+2 D.2 n(C)+ n(N)+1
二、选择题(本题包括10小题,每小题4分,共40分,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列物质中,属于天然高分子化合物的是( )
A.淀粉 B.火棉 C.植物油 D.聚丙烯
10.氟里昂又称氟氯烷,它有多种用途,常作为冰箱的致冷剂,但它对大气臭氧层有破坏作用,世界卫生组织呼吁减少它的生产和使用,下列物质属氟里昂系列的是( )
A.F2C=CCl2 B.CF2Cl2 C.CHF=CHF D.Cl2FC—CF2Cl
11.水的沸点是100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是―60.7℃,引起这种差异的主要原因是 ( )
A.范德华力 B.共价键 C.氢键 D.相对分子质量
12.下列关于“生活中的化学”的叙述中不正确的是
A.棉花和蚕丝的主要成分都是纤维素
B.误食重金属盐,立即喝牛奶或生鸡蛋清进行解毒
C.植物油的主要成分是高级不饱和脂肪酸甘油脂,是厨房调味品之一
D.苯酚的稀溶液可作防腐剂和消毒剂,也是常用的食品添加剂
13.下列除杂方法中正确的一组是
A.溴苯中混有溴,加入碘化钾溶液后用汽油萃取
B.除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层
C.乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气
D.苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏
14.一个学生做乙醛的还原性实验时,取1mol·L-1CuSO4溶液和0.5 mol·L-1NaOH溶液各1 mL在一支洁净的试管内混合后,向其中又加入的乙醛,加热煮沸,结果无红色沉淀出现。实验失败的原因可能是
A.未充分加热 B.加入乙醛太少
C.加入NaOH溶液的体积不够 D.加入CuSO4溶液的体积不够
15.下列物质的熔沸点高低顺序中,正确的是
A.金刚石>晶体硅>碳化硅 B.CBr4>CCl4>CF4
C.MgO>H2O>O2 D.钠>镁>铝
16.在pH=1的溶液中,一定可以大量共存的离子组是
A.Cl-、AlO2-、Na+、K+ B.SO42-、NO3-、Fe2+、Mg2+
C.Na+、Fe3+、SO42-、Cl- D.NH4+、Ba2+、Cl-、HCO3-
17.某有机物结构简式为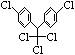 ,有关它的说法正确的是
,有关它的说法正确的是
A.它属于芳香烃 B.分子中最多有23个原子共面
C.分子式为C14H8Cl5 D.1 mol该物质能与6 molH2加成
18.下列各组有机物不论以何种比例混合,只要二者物质的量之和不变,完全燃烧时所消耗的氧气的物质的量和生成水的物质的量分别相等的是( )
A.甲烷和甲酸甲酯 B.乙烷和乙醇
C.苯和苯甲酸 D.乙炔和苯
扬州市2003—2004学年度第二学期期末调研测试试题
高 二 化 学
可能用到的相对原子质量:
H:1;O:16;Na:23;C:12
第I卷答题栏
一.二选择题(1~8小题,每小题只有一个选项符合题意,每小题4分,共32分;9~18小题,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| 答案 |
| |||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | |||||||||
第II卷(非选择题 共78分)
三、(本题包括2小题,共20分)
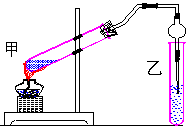 19.(9分)右图是某学生设计的制取乙酸乙酯的实验装置图,该学生并进行了以下主要实验操作:①在甲试管中加入适量乙醇,浓硫酸和冰醋酸;②小心均匀加热3min~5min。
19.(9分)右图是某学生设计的制取乙酸乙酯的实验装置图,该学生并进行了以下主要实验操作:①在甲试管中加入适量乙醇,浓硫酸和冰醋酸;②小心均匀加热3min~5min。
(1)该学生所设计的图及所进行的实验操作中,错误的是__________(填下列选项的标号)
A.乙试管中的导管插入溶液中 B.乙试管中盛饱和Na2CO3溶液
C.先加浓硫酸后加乙醇、冰醋酸 D.甲试管中导管太短
E.乙试管中盛饱和碳酸氢钠溶液
(2)甲试管中可放入干燥的碎瓷片,其作用是 。
(3)需小心均匀加热的原因是________________________________________。
(4)从反应后的混合物中提取乙酸乙酯,宜采用的简便方法是__________(填下列选项的标号)
A.蒸馏 B.渗析 C.分液 D.过滤 E.结晶
(5)在装置中,球形干燥管主要起到两个作用:a ,b _____ ___ _____。
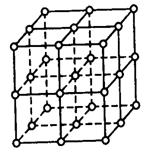
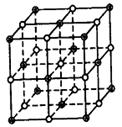
20.(11分)氯化钠晶体易溶于水,不溶于苯或四氯化碳。右图中直线交点处的圆圈为氯化钠晶体中Na+ 离子或Cl-离子所处的位置。
(1)请将其中代表Na+离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体的结构示意图。
![]() (2)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有
个。
(2)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有
个。
(3)晶体中每一个重复的结构单元叫晶胞。在氯化钠晶胞中正六面体的顶点上、面上、棱上的Na+离子或Cl-离子为该晶胞与其相邻的晶胞所共有。一个晶胞中,Cl-离子的个数等于 , Na+离子的个数等于 。
(4)利用X射线可测得氯化钠晶体中靠得最近的Na+离子与Cl-离子之间的距离为d,借助这一数据,某化学实验小组设计了一个测定阿伏加德罗常数的方案,该方案的关键是要测定氯化钠晶体的密度。
①若实验室现有天平、酸式滴定管(25mL)、容量瓶(25mL)等仪器,请你设计一个测定氯化钠晶体密度的实验方案(氯化钠晶体已研细,其它试剂自选)。
②经测定氯化钠晶体的密度为ρ摩尔质量为M,试写出计算阿伏加德罗常数的公式(式中物理量都用字母表示) 。
四、(本题包括4小题,共40分)
21.(10分)几年来,有些不法商贩因在食品中填加了“吊白块”以达到漂白增色、防腐、增加米面制品的韧性及口感的目的受到了国家质检总局的严肃查处。“吊白块”化学名称为甲醛次硫酸氢钠,是由甲醛和次硫酸氢钠(可表示成Na+[OSOH-])反应制得:
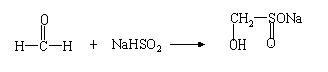
回答下列问题:
(1)“吊白块” (填“易”、“难”)溶于水。
(2)甲醛能使 变性凝固,所以可用其浓溶液保存动物标本和尸体。
(3)甲醛是非常重要的合成原料。纯净的甲醛在催化剂的作用下,生成聚甲醛—— 一种优良的工程塑料,聚甲醛的结构简式为 ;俄国化学家布特列洛夫在1861年首次发现在弱碱作用下,6个甲醛分子加合得到己糖,则此己糖的分子式为 。
(4)已知:C + H2O![]() 某混合气体M ,
某混合气体M , ![]() +某混合气体M
+某混合气体M ![]() A
A![]() B 其中A可还原新制的Cu(OH)2悬浊液亦可与乙酸发生酯化反应;B的相对分子质量是
B 其中A可还原新制的Cu(OH)2悬浊液亦可与乙酸发生酯化反应;B的相对分子质量是![]() 的整数倍,自然界中常以盐的形式存在于多种植物的细胞膜中,B可洗除衣物上的铁锈渍。则:
的整数倍,自然界中常以盐的形式存在于多种植物的细胞膜中,B可洗除衣物上的铁锈渍。则:
①A的同分异构体有(填结构简式) 、 。
②A催化加氢的化学方程式 。
③B可被酸性KMnO4 溶液氧化,在方框中填上B的结构简式并配平离子方程式。
+ MnO4- + H+ — CO2↑+ Mn2+ + H2O
22.(10分)已知CH3CH2CH2NO2性质稳定,它既不与NaOH反应,又不与盐酸反应。下图是某有机物的球棍模型,请根据模型写出此有机物的分子式 ,它的结构简式是 。
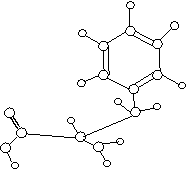
它的同分异构体有多种,其中A和B分子中均含有苯环,且苯环上只有两个邻位取代基,取代基所含的原子数相差1个。
(1)A既能与强酸反应,又能与强碱反应,则A的结构简式为 (任写其中一种);
(2)B既不溶于强酸,又不溶于强碱,则B的结构简式为 (任写其中一种)。
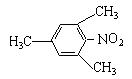
(3)若C是B的同分异构体,它可以看作是芳香烃经一硝化后的唯一产物(硝基连在苯环上)。则C的结构简式为 。
23.(9分)酯和醇反应生成新的酯和新的醇的反应称为酯交换反应:

工业上生产的“的确良”是以甲醇、乙二醇和对苯二甲酸(![]() )为原料生产的。具体合成途径如下:
)为原料生产的。具体合成途径如下:
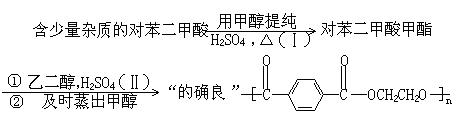
完成下列填空:
(1)反应(Ⅰ)的化学方程式为 。
(2)反应(Ⅱ)的类型是 (填加聚或缩聚)。
(3)反应(Ⅱ)中为何要及时蒸出甲醇? 。
(4)合成时,若消耗的乙二醇的物质的量比对苯二甲酸多千分之五,上述聚合物中的链节数n= 。
24.(11分)有机物参加的反应往往比较复杂,常有副反应发生;如下图中乙烯跟溴水反应既可生成A.同时又可生成B和C2H5Br。
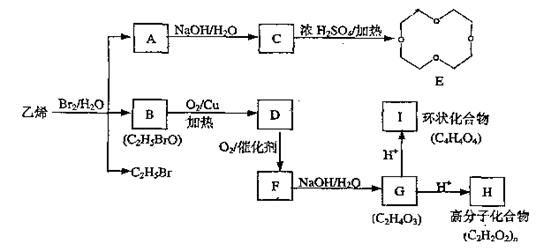
回答下列问题:
(1)环氧乙烷(![]() )的结构可简写为
)的结构可简写为![]() 则E的分子式是 。
则E的分子式是 。
(2)B的结构简式是 ;I的结构简式是 。
(3)写出G转化为H的化学方程式:
(4)化合物A~I中,易发生加成反应的物质是 (填字母)。
五、计算题:(本题包括2小题,共18分)
25.(8分)某饱和一元羧酸和饱和一元醇所生成的酯1.76g与30mL 1mol/L的NaOH溶液在加热下反应,待反应完全后,测得生成饱和一元醇0.92g,反应后的混合物中剩余的NaOH需用40mL 0.25mol/L盐酸才能刚好中和。求这种酯的结构简式及名称。
26. (10分)乙烯和乙烷的混合气体共amol, 与bmol的氧气共存于一密闭容器中, 点燃后充分反应, 乙烯和乙烷全部消耗完, 得到CO和CO2的混合气体和45g的水, 求:
(1)当a=1时, 乙烯和乙烷的物质的量之比为多少?
(2)当a=1时, 且反应后CO和CO2的混合气体的物质的量为反应前氧气的![]() 时, 求b的值和此时生成CO和CO2的物质的量的比值.
时, 求b的值和此时生成CO和CO2的物质的量的比值.
(3)a的取值范围是多少?
扬州市2003—2004学年度第二学期期末调研测试试题
高二化学答案及评分标准
第Ⅰ卷(选择题 共72分)
一.二选择题(1~8小题,每小题只有一个选项符合题意,每小题4分,共32分;9~18小题,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| 答案 | D | B | B | C | D | A | B | A |
| |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | BD | C | AD | BD | C | BC | C | BD | AC |
第II卷(非选择题 共78分)
三、(本题包括2小题,共20分)
19.(9分)
(1)C、E 每个1分,计2分;错选1个扣1分,扣完2分为止
(2)防止暴沸 2分
(3)防止乙醇、乙酸挥发 2分
(4)C 1分
(5)冷凝、防止倒吸 各1分
20.(11分)
(1) 2分
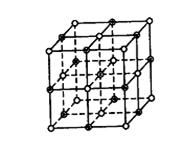
或
(2)12 2分
(3)4;4 各1分
(4)①用天平精确称量适量的NaCl晶体,并装入容量瓶中;向酸式滴定管中加入有机溶剂苯或四氯化碳,调整液面至零刻度;通过滴定管向容量瓶中加入苯或四氯化碳,并适当摇动容量瓶,当液面接近刻度线时,小心滴入苯或四氯化碳至凹液面与刻度线水平;读取所滴加液体的体积数据,计算氯化钠晶体的密度。
3分
②NA=M/(2d3ρ)mol-1 2分
四、(本题包括4小题,共40分)
21.(10分)
(1)易 1分
(2)蛋白质 1分
(3)—[—CH2—O—]n— ;C6H12O6 各1分
(4)①CH3COOH;HCOOCH3 各1分
②

2分
③
![]() 2分
2分
22.(10分)
C9H11NO2; 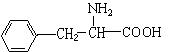 各2分
各2分
(1)![]() 2分
2分
(2)![]() 2分
2分
(3) 2分
2分
23(9分)
(1) 2分
2分
(2)宿聚 2分
(3)提高反应物的转化率 2分
(4)200 3分
24.(11分)
(1)、C8H16O4
2分(2)、HO-CH2-CH2-Br
2分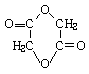 2分
2分
(3)、nHOOC-CH2OH→![]() + nH2O
3分
+ nH2O
3分
(4)、D 2分
五、计算题:(本题包括2小题,共18分)
25.(8分)
n(酯)= n(酸)= 0.03L×1mol/L-0.04L×0.25mol/L==O.O2mol 2分
M(酯)== 1.76g/0.02mol=88g/mol
M(醇)== 0.92g/0.02mol=46g/mol 由此推出为乙醇
M(酸)== 88g/mol+18g/moL-46g/mol==60g/mol 由此推出为乙酸 3分
所以该酯为:CH3COOCH2CH3,乙酸乙酯 3分
26.(10分)
(1)由H守恒可得乙烯和乙烷的物质的量之比为1:1 2分
(2)由C守恒可得b=1mol×2/(2/3)=3mol 2分
![]() n(CO)+ n(CO2)== 2mol
(C守恒)
n(CO)+ n(CO2)== 2mol
(C守恒)
n(CO)+2 n(CO2)+ n(H2O)==== 3mol×2 (O守恒)
![]() n(CO)==0.5mol
n(CO)==0.5mol
n(CO): n(CO2)== 1:3 4分
n(CO2)=1.5 mol
(3)由极端假设可得取值范围为5/6〈a〈5〈5/4 2分