高二年级第一学期期中考试(理科)
化学试题
可能用到的相对原子质量H—1.;C—12. ; 0—16 ; Ca—40 ; N—14; Cu—64
一、单项选择题(每小题2分,共20分)
1.下列气体能用碱石灰干燥的是 ( )
A.Cl2 B.NH3 C.HC1 D.CO2
2.能充分说明可逆反应N2(g)+O2(g)![]() 2NO(g)已达到平衡状态的是 ( )A.O2的消耗速率等于NO的消耗速率
2NO(g)已达到平衡状态的是 ( )A.O2的消耗速率等于NO的消耗速率
B.容器中存在N2、O2、NO三种气体
C.容器混合物总的物质的量不随时间而改变
D.单位时间内每生成n mol N2的同时生成2n mol NO
3.下列反应达平衡后,缩小体积,增大压强或升高温度,平衡都向同一方向移动的是( )
A.2NO2![]() N2O4(正反应为放热反应)
N2O4(正反应为放热反应)
B.NH4HCO3(s)![]() NH3+H2O(g)+CO2(正反应为吸热反应)
NH3+H2O(g)+CO2(正反应为吸热反应)
C.3O2![]() 2O3(正反应为吸热反应)
2O3(正反应为吸热反应)
D.H2S![]() H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
4. 可逆反应A(g)+3B(g) ![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中反应速率最快的是 ( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中反应速率最快的是 ( )
A. vA=0.5mol/ (L·s) B. vB =0.6mol/ ( L·s)
C. vc=0.4mol/ ( L·s) D. vD=0.45mol/ (L·s)
5. 鉴别二氧化氮和溴蒸气应选用的试剂是 ( )
A. NaOH溶液 B. AgNO3溶液.
C. 淀粉碘化钾溶液 D. 石蕊试液
6.下列各组离子,在强酸性溶液中能大量共存的是 ( )
A. K+、Na+、F-、NO-3
B. Na+ Fe2+、Cl-、N03-
C. N0-3、Cl-、Na+、K+
D. SO23-、NO3-、Na+、K+
7. 下列各组气态氢化物中,按稳定性由弱到强的顺序排列正确的是 ( )
A. AsH3、PH3、H2S、HCl B. HF、HCl、HBr、HI
C. NH3、H20、HF、H2S D. H2O、NH3、CH4、H2S
8.在一定温度和压强下,将装有氮气和二氧化氮混合气体的试管倒立于水中,经足够时间后,试管内气管内气体积缩小为原体积的![]() ,则原混合气体中氮气和二氧化氮气体的体积比是
( )
,则原混合气体中氮气和二氧化氮气体的体积比是
( )
A. 2:3 B. 3:2 C. 3:5 D.5:3
9. 下列试剂的保存方法,错误的是 ( )
A. 把浓硝酸放在棕色瓶中,并置于冷暗处保存
B. 把AgNO3放在棕色瓶中保存
C. 把NaOH溶液放在带橡皮塞的玻璃瓶中
D. 把氢氟酸放在玻璃瓶中,把白磷保存在煤油中
10. 在一个1L的密闭容器中,通入3L的x(g)和2L的Y(g),在一定条件下发生下列反应:4x (g)+3Y(g) ![]() 2Q(g)
+nR (g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,x的浓度减小
2Q(g)
+nR (g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,x的浓度减小![]() ,则该反应方程式中的n的值是
( )
,则该反应方程式中的n的值是
( )
A. 3 B. 4 C.5 D.6
二、选择题(本题包括10小题每小题3分,共30分:每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分:若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
11. 在容积相等的两密闭容器A和B中,保持温度423K,同时向A、B中分别加入a mol及b mol碘化氢(a>b),待反应2HI(g)![]() H2(g)+I2(g)达平衡后,下列说法肯定正确的是
( )
H2(g)+I2(g)达平衡后,下列说法肯定正确的是
( )
A. 化学反应速率vA<vB
B. 平衡时I2的浓度c (I2)A= c(I2)B
C. 平衡时碘蒸气的混合气体中的质量分数,A容器大于B容器
D. 平衡时HI的分解率相同
12. 把200mI1 mol·L-1HNO3与Cu反应后的溶液,小心蒸发得到7.26 gCu(N03)2 ·3H2O晶体,则起氧化作用的HNO3的物质的量约为 ( )
A. 0.0l mol B. 0.02 mol C. 0.03 mol D. 0.06 mol
13. 在等温等容条件下,有反应2A(g)+2B(g) ![]() C(g)+3D(g),现分别从两个途径建立平衡:(I)A、B的起始浓度均为2 mol·L-1 (Ⅱ)C、D的起始浓度分别为 2mol ·L-1、6 mol ·L-1。下列叙述正确的是 ( )
C(g)+3D(g),现分别从两个途径建立平衡:(I)A、B的起始浓度均为2 mol·L-1 (Ⅱ)C、D的起始浓度分别为 2mol ·L-1、6 mol ·L-1。下列叙述正确的是 ( )
A. Ⅰ、Ⅱ两个途径最终达到平衡时,容器内混合气体中各种成分体积分数相同
B. Ⅰ、Ⅱ两个途径最终达到平衡时,容器内混合气体中各种成分体积分数不相同
C. 达平衡时,Ⅰ途径反应速率v1等于Ⅱ途径反应速率v2
D. 达平衡时,Ⅰ平衡混合气体的密度为Ⅱ平衡密度的![]()
14. E(s)+3F(g)![]() 2G(g)(正反应为吸热反应),如图表示外界条件(温度、压强)
2G(g)(正反应为吸热反应),如图表示外界条件(温度、压强)
的变化对下列反应的影响。在图中Y轴是指 ( )
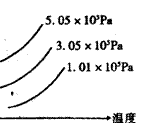 A. F的转化率
A. F的转化率
B. E的物质的量
C. 平衡混合物中G的百分含量
D.平衡混合物中F的百分含量
15. 某单质和浓硝酸反应时,每有 0.25mol单质反应消耗1mol HNO3,还原产物为NO2,则单质氧化后的化合价可能是( )
A. +1 B. +2 C. +3 D. +4
16. 某温度下1L密闭容器中,加入1mol N2和3mol H2,使反应N2(g)+3H2(g)![]() 2NH3(g)达平衡,测得平衡时,NH3的浓度为Cmol/L,若维持容器体积不变,温度不变,以下配比作为起始物质,达到平衡时NH3的浓度仍为Cmol/L的是
( )
2NH3(g)达平衡,测得平衡时,NH3的浓度为Cmol/L,若维持容器体积不变,温度不变,以下配比作为起始物质,达到平衡时NH3的浓度仍为Cmol/L的是
( )
A. 2mol NH3
B.2mol N2+6mol H2
C. 0.5mol N2+1.5 molH2+1mol NH3
D.1mol N2+3mol H2+1mol NH3
17. 将1mol So2和1mol O2通入恒容密闭容器中,在一定条件下反应达到平衡,平衡时,SO3达到0.3 mol。此时若移走0.5 mol O2和0.5 mol SO2,则反应达到新的平衡时,SO3的物质的量是 ( )
A. 0.3 mol B.0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
18.在一定温度下,反应H2(g)+I2(g)![]() 2HI(g)在密闭容器中进行,当下列情况不随时间变化时,能说明反应已达到平衡的是
( )
2HI(g)在密闭容器中进行,当下列情况不随时间变化时,能说明反应已达到平衡的是
( )
A. 容器内的压强 B. 混合气体的平均相对分子质量
C. 各组分的百分含量 D. 混合气体的颜色
19.在一密闭恒容的容器内进行下列反应4NH3(g)+502(g)![]() 4NO(g)+6H2O(g),在一定条件下建立平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是 ( )
4NO(g)+6H2O(g),在一定条件下建立平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是 ( )
A. 容器内压强增大 B. 原平衡不受影响
C. 正反应速率减小 D. NO的浓度降低
20. 在一固定体积的密闭器中,保持一定温度,进行以下反应H2(g)+Br2(g)
![]() 2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr。在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为0),如果仍保持平衡时各组分的质量分数不变,以下判断正确的是
( )
2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr。在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为0),如果仍保持平衡时各组分的质量分数不变,以下判断正确的是
( )
A. x、y应满足的关系是y=2x
B. x、y、z应满足的关系是4x+z=2y
C. 达到平衡时HBr物质的量为![]() mol
mol
D. 达到平衡时HBr物质的量一定为a mol
三、填空题(共38分)
21. 实验室制取氨气,所用装置与制________气的装置相同,反应的化学方程式为____________。如氨气已充满容器,这时将蘸有浓盐酸的玻璃棒接近,可观察到___________现象。
22. 除去NO中混有的NO2,采用的方法是________________________
23. 1 L密闭容器中,使气体A分解,达到平衡后,A的分解率为20%,A的平衡浓度为2mol/L,则A的起始浓度为______________mol/L。
24.根据下列事实完成下列反应的化学方程式:
(1)AsH3是一种很强的还原剂,在室温下,它能在空气中自燃,其氧化产物为As2O3,写出反应的化学方程式 。
(2)砷为氮族元素,其氧化物As2O3俗名砒霜,有剧毒,可用马氏试砷法来检验,其原理是:将锌、盐酸和食物试样混合,其含有砒霜,则会生成砷化氢气体,这一反应的离子方程式是
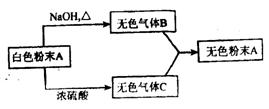
25. 如下图所示,气体B和C都具有刺有激性气味,B能使湿润的红色石蕊试纸变蓝,C与AgNO3溶液作用能产生不溶于硝酸的白色沉淀,B与C相遇会产生白烟。试推断A的化学式__________,B的化学式_____________, C的化学式_____________,写出B与C反应生成A的化学方程式_____________。
26. (1)反应mA+nB![]() PC在某温度下达到平衡。
PC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________;:
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向_____________方向移动;
③如果在体系中增加或减少B的量,平衡不发生移动,则B肯定不能为_____________态;
④若升高温度,A的转化率降低,此反应的逆反应是_____________热反应。
(2)有可逆反应A(g)+B(g) ![]() 3C(g),下图分别表示在不同条件下,生成物C在反应混和物中的百分含量(C%)和反应时间(t)的关系图。
3C(g),下图分别表示在不同条件下,生成物C在反应混和物中的百分含量(C%)和反应时间(t)的关系图。
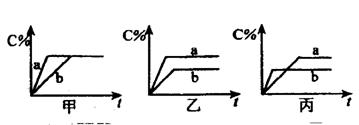
按下述要求填空:
①若甲图中两条曲线分别表示有无催化剂时的情况,则_____________曲线表示无催化剂;②若乙图两条曲线表示200°C和100°C的情况,则该可逆反应是_____________热反应;③若丙图中两条曲线分别表示不同压强下的情况,则_____________曲线是表示压强较大时的情况。
27.配平下列化学方程式□Fe+□H2SO4(浓)![]() □Fe2(SO4)3+□ SO2↑+□H2O。其中被还原的H2SO4与未被还原的H2SO4物质的量之比是______________。
□Fe2(SO4)3+□ SO2↑+□H2O。其中被还原的H2SO4与未被还原的H2SO4物质的量之比是______________。
28. 将3.20gCu跟10.0mol/L的硝酸30.0mL充分反应,还原产物中有NO和NO2。若反应后溶液中有amol H+则此时溶液中NO-3的物质的量为_____________
29.在100℃和200kPa的条件下,反应aA(g) bB(g)+c C(g)建立平衡后,在不
加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反
应建立平衡时物质B的浓度。
| 压强(kPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡 移动(填“正向”或“逆向”或“不”),理由是 。
(2)压强从500kPa增加到1000kPa时,平衡 移动(填“正向”或“逆向”或“不”),其原因可能为 。
30. 在密闭容器中,用等体积的NO和O2混合,NO的转化率与温度的关系如下:
| 温度(℃) | 230 | 300 | 600 | 670 |
| 转化率(%) | 95 | 80 | 19 | 5 |
据此可判断:
⑴NO与O2的反应是 热反应(填“吸”或“放”)理由是
。
⑵NO和O2的反应 可逆反应(填“是”或“不是”),理由是
。
四、计算题(本题共12分)
31. 373K时,把0.5mol N204气体通入体积为5L的真空密闭容器中反应,立即出现红棕色,当反应进行到2s时NO2的浓度为0.02mol/L,在60s达到平衡,此时容器内的压强为开始时的1.6倍,求:
(1)2s时体系内的压强为开始时压强的多少倍?
(2)平衡体系中含N2O4的物质的量为多少?
(3)问2s时以N2O4的浓度表示的平均反应速率是多少?
32.有平均相对分子质量为8.5的氮、氢混合气体,通过合成塔出来的混合气体平均分子质量为9.44,求氮气的转化率。
高二化学期中考试答题纸(理科)
一选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1+ | ||||||||||
| 10+ |
二填空题:
21. , 。
。
22. 。
23. 。
24.(1) 。
(2) 。
25. ; ; ;
。
26.(1):① 。② 。
③ 。④ 。
(2):① 。② 。
③ 。
27.□Fe+□H2SO4(浓)![]() □Fe2(SO4)3+□ SO2↑+□H2O
□Fe2(SO4)3+□ SO2↑+□H2O
。
28. 。
29.(1) 。
(2) 。
30.(1) 。
。
(2) 。
。
31.
32.
高二化学参考答案
一、1.B 2.D 3.C 4.A 5.B 6.C 7.A 8.A 9.D 10. D
二、11.D 12.B 13.A.D 14.AC 15.BD 16.A.C 17.C 18.C.D 19.C.D 20.BC
三、21氧. 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
有大量白烟
22. 通过盛有水的洗气瓶
23. 2.5mol/L
24. (1)2AsH3+3O2=As2O3+3H2O
(2)6Zn+As2O3+12H+=6Zn2++AsH3↑+3H2O
25. NH4Cl NH3 HCl NH3+HCl=NH4Cl
26.(1) ① m+n>p ② 逆反应 ③气 ④吸
(2)① b ② 吸 ③b
27. 2. 6→1,3,6 1:1
28. (a+0.l00)mol
29.(1)不移动、浓度增大的倍数和压强增大的倍数相同
(2)正向、加压至1000KPa时C物质变成了非气态物质
30.(1)放;升温NO的转化率变小说明平衡向生成NO的反应方向移动,所以NO与 O2的反应是放热的。
(2)是;等体积的NO与 O2反应,O2过量, NO不足但有剩余说明反应进行不完全,是可逆反应。
四、计算题31,(1)1.1 (2)0.2 mol (3)0.005mol/(L·s)
32.20%