高二上期期末八校联考测试题
化学试题
班级 姓名 成绩
说明:1、本卷满分100分,考试时间100分钟。
2、可能用到的相对原子质量:H—1 N—14 O—16 S—32 Cl—35.5
K—39 Fe—56 Cu—64
一、选择题(每题只有1个正确答案,每题2分,共20分)
1.下列气体不会造成大气污染的是 ( )
A. 二氧化硫 B. 氮气 C. 一氧化碳 D. 一氧化氮
2.在1 L 1 mol / L的氨水中 ( )
A. 含1 mol NH3分子
B. 含NH3和![]() 之和为1 mol
之和为1 mol
C. 含NH3、![]() 、NH3·H2O之和为1 mol
、NH3·H2O之和为1 mol
D. 含NH3·H2O为1 mol
3.下列金属只能与高温水蒸气反应而不能与热水反应的是 ( )
A. Ca B. Mg C. Fe D. Cu
4.为检验某FeCl2溶液是否变质,可向溶液试样中加入 ( )
A. 铁片 B. 石蕊试液 C. KSCN溶液 D. 氯水
5.pH=1的H2SO4溶液中由水所电离出的[H+]为 ( )
A. 0.1 mol / L B. 10-7 mol / L C. 10-14 mol / L D. 10-13 mol / L
6.将下列固体在隔绝空气的密闭容器中用酒精灯加热,在加热的过程中,发生了化学反应,但冷却后又聚集为原来物质的是 ( )
A. 碘片 B. 氯化铵 C. 碘化铵 D. 碳酸钠
7.五氧化二磷不仅是一种强干燥剂,而且有很强的脱水性,向浓硝酸中加入过量的P2O5,能生成一种含氮化合物M,则M最可能是 ( )
A. N2 B. NO2 C. NO D. N2O5
8.以下关于化学反应速率的论述中正确的是 ( )
A. 化学反应速率可用某时刻生成物的物质的量来表示
B. 同一反应中,用反应物或生成物表示的化学反应速率数值是相同的
C. 化学反应速率是指反应进行的时间内反应物浓度的减少或生成物浓度的增加
D. 可用单位时间内氢离子物质的量浓度变化来表示NaOH和H2SO4的反应速率
9.下列说法正确的是 ( )
A. 强电解质溶液一定比弱电解质溶液的导电性强
B. 电解质一定能导电
C. 强电解质的溶解度一定大,弱电解质的溶解度一定小
D. 弱电解质的溶液中一定存在电离平衡
10.pH相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下,放出二氧化碳气体的体积是 ( )
A. 一样多 B. 醋酸比硫酸多
C. 硫酸比醋酸多 D. 无法比较
二、选择题(每小题只有一个正确答案。每小题3分,共30分)
11.1999年曾报导合成和分离了含高能量的正离子![]() 的化合物N5AsF6,下列叙述错误的是
( )
的化合物N5AsF6,下列叙述错误的是
( )
A. ![]() 具有34个核外电子
具有34个核外电子
B. ![]() 中氮—氮原子间以共用电子对结合
中氮—氮原子间以共用电子对结合
C. 化合物N5AsF6中As的价为+1价
D. 化合物N5AsF6中F的价为 -1价
12.在一定温度下的固定容积的密闭容器中,反应A2(g)+B2(g)![]() 2AB(g),达到平衡的标志是
( )
2AB(g),达到平衡的标志是
( )
A. 单位时间内生成n mol A2,同时生成n mol AB
B. 容器内的总压强、密度和平均相对分子质量均不随时间变化
C. 容器内A2、B2、AB的物质的量之比1∶1∶2
D. 单位时间内生成2n mol的AB同时生成n mol的B2
13.20℃时H2S饱和溶液1 L,其浓度为0.1 mol / L,其电离方程式为H2S![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-,若要使溶液的pH值和[]减小,可采取的措施是
( )
H++S2-,若要使溶液的pH值和[]减小,可采取的措施是
( )
A. 通入适量的H2S气体 B. 加入少量的氢氧化钠固体
C. 加入适量的CuSO4固体 D. 加入适量水
14.已知一种pH=3的酸和一种pH=11的碱以等体积混合后溶液呈酸性,其原因可能是 ( )
A. 浓的强酸溶液和稀的强碱溶液反应
B. 浓的弱酸溶液和稀的强碱溶液反应
C. 等物质的量浓度的强酸溶液和弱碱溶液反应
D. 生成了一种强酸弱碱盐
15.根据下列化学方程式
① 2![]() 十16H+十10Cl-=2Mn2+十8H2O十5Cl2
十16H+十10Cl-=2Mn2+十8H2O十5Cl2
② 2Fe2++Cl2=2Fe3++2Cl-
③ 2Fe3++Cu=2Fe2++Cu2+
④ Fe+Cu2+=Fe2++Cu
可推断![]() 、Fe2+、Cu2+、Fe3+、Cl2的氧化性由强到弱的顺序为
( )
、Fe2+、Cu2+、Fe3+、Cl2的氧化性由强到弱的顺序为
( )
A. ![]() >Cl2>Fe3+>Cu2+>Fe2+
>Cl2>Fe3+>Cu2+>Fe2+
B. Fe3+>![]() >Cl2>Cu2+>Fe2+
>Cl2>Cu2+>Fe2+
C. Cl2>![]() >Fe3+>Cu2+>Fe2+
>Fe3+>Cu2+>Fe2+
D. Cu2+>Cl2>![]() >Fe3+>Fe2+
>Fe3+>Fe2+
16.某无色透明溶液能与Al反应析出H2,则此溶液中可能大量存在的是 ( )
A. OH-、Ba2+、Cl-、![]() B. H+、Mg2+、
B. H+、Mg2+、![]() 、Na+
、Na+
C. H+、Cu2+、![]() 、K+
D. H+、Cl-、
、K+
D. H+、Cl-、![]() 、Mg2+
、Mg2+
17.在Na2S溶液中存在的下列关系正确的是 ( )
A. c(Na+)=c(S2-) B. c(Na+)∶c(S2-)=2∶1
C. c(Na+)∶c(S2-)>2∶1 D. c(Na+)∶c(S2-)<2∶1
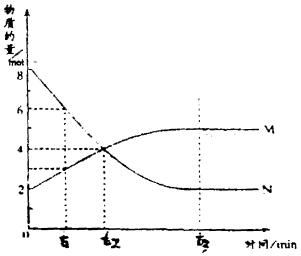 |
18.在一定温度下容器内某一反应中,M、N的物质的量随时间变化的曲线如图,所示下列表述中正确的是 ( )
A. 反应的化学方程式为2M=N
B. t2时的正逆反应速率相等,达到平衡
C. t3时的正反应速率大于逆反应速率
D. t1时N的浓度等于M的浓度的2倍
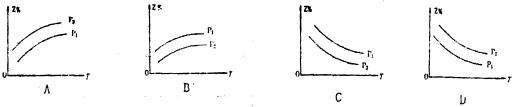
19.如图所示,反应X(g)+3Y(g)![]() 2Z(g)+Q,在不同温度、不同压强( P1<P2)下,达到平衡时,混合气体中Z的体积分数Z%随温度变化的曲线应为
( )
2Z(g)+Q,在不同温度、不同压强( P1<P2)下,达到平衡时,混合气体中Z的体积分数Z%随温度变化的曲线应为
( )
20.下列方程式属于水解反应的是 ( )
A. H2O+H2O ![]() H3O++H+
H3O++H+
B. ![]() +H2O
+H2O![]() H3O++
H3O++![]()
C. ![]() +OH-=H2O+
+OH-=H2O+![]()
D. ![]() +H2O
+H2O![]()
![]() +OH-
+OH-
三、实验题(共16分)
21.下面是某学生用已知浓度的盐酸溶液测定未知浓度的NaOH溶液的部分操作,其中错误的是
A. 取一锥形瓶,用待测NaOH溶液润洗两次后装入25 mL待测NaOH溶液
B. 加入几滴石蕊试液作指示剂
C. 取一支酸式滴定管,洗涤干净后直接往其中注入标准盐酸溶液
D. 滴定时,两眼注视滴定管内盐酸溶液液面下降,直至滴定终点
22.实验室常用饱和的NaNO2和NHCl溶液反应制取纯净的氮气用于合成氨气,反应式为NH4Cl+NaNO2![]() NaCl+2H2O+N2。实验装置如图所示,试回答:
NaCl+2H2O+N2。实验装置如图所示,试回答:
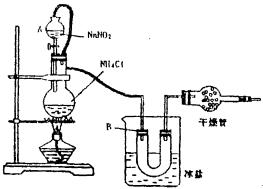 (1) 装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用
(填编号)
(1) 装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用
(填编号)
a. 防止NaNO2饱和溶液蒸发
b. 保证实验装置不漏气
c. 使NaNO2饱和溶液容易滴下
(2) B部分的作用是
a. 冷凝
b. 缓冲气流
c. 冷却氮气
(3) 加热前必须进行的一个操作步骤是(用文字说明) 加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 (用文字说明)
 (4) 收集N2前,必须进行的步骤是(用文字说明)
,收集氮气最适宜的方法是
。
(4) 收集N2前,必须进行的步骤是(用文字说明)
,收集氮气最适宜的方法是
。
a. 用排空气法收集在集气瓶中
b. 用排水法收集在集气瓶中
c. 直接收集在球胆或塑料袋中
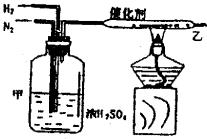
(5) 实验室合成氨装置如图所示,试回答:装置甲的作用是
a.
b.
c.
从乙处导出的气体是
四、填空(共21分)
23.请完成并配平反应
KMnO+ H2S+ H2SO4= K2SO4+ MnSO4+ S↓+
该反应中电子转移总数是 ,当反应中有80 g硫析出时,有 mol还原剂被氧化。
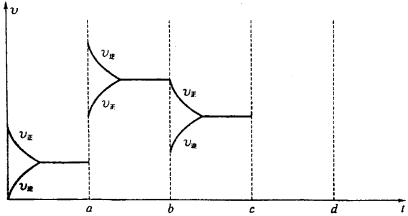
24.下图表示在密闭容器中反应2A+B(g)![]() 2C(g)+Q( Q>0)达到平衡时,由于条件改变而引起的反应速率和化学平衡的变化:a ® b过程改变的条件可能是(填“升温”或“降温”)
,平衡
(填“正向”、“逆向”或“不”)移动,C的体积分数
(填“增大”、“减小 ”或“不变”),b ® c过程中改变的条件可能是
(填“加压”、“降压”、“分离C”或“加入A或B”),c ® d过程中压强变为原来的2倍(缩小体积)、C的浓度变为原来的1.9倍,则平衡
(填“正向”、“逆向”或“不”)移动,说明A一定为
(填“气态”、“液态”、“固态”或“液态或固态”),请将后反应速率变化情况画在c ® d处。
2C(g)+Q( Q>0)达到平衡时,由于条件改变而引起的反应速率和化学平衡的变化:a ® b过程改变的条件可能是(填“升温”或“降温”)
,平衡
(填“正向”、“逆向”或“不”)移动,C的体积分数
(填“增大”、“减小 ”或“不变”),b ® c过程中改变的条件可能是
(填“加压”、“降压”、“分离C”或“加入A或B”),c ® d过程中压强变为原来的2倍(缩小体积)、C的浓度变为原来的1.9倍,则平衡
(填“正向”、“逆向”或“不”)移动,说明A一定为
(填“气态”、“液态”、“固态”或“液态或固态”),请将后反应速率变化情况画在c ® d处。
25.下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末(反应条件及部分反应物、产物未全部说明)
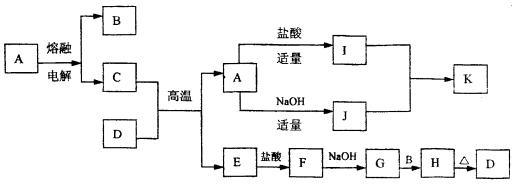
根据图示转化关系填写下列空白:
(1) 写出下列物质的化学式A ,B ,G 。
(2) C与D的混合物通常称 (填名称)。
(3) 写出下列化学方程式或离子方程式
I+J ® K (离子方程式)。
G+B ® H (化学方程式)。
(4) I的溶液通常显酸性,请用离子方程式解释原因 。
五、计算:(共18分)
26.将0.6 mol X气体和0.4 mol Y气体混合于2 L容器中使它们发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),5 min末时已生成02 mol W,若测知以Z浓度变化来表示化学反应速率为0.01 mol /(L·min)。求:
nZ(g)+2W(g),5 min末时已生成02 mol W,若测知以Z浓度变化来表示化学反应速率为0.01 mol /(L·min)。求:
(1) 以X的浓度变化来表示化学反应速率为多少?
(2) 反应中Z气体的化学计量数n的值是多少?
27.加热500 g含(NH4)2SO4 13.2%的硫酸铵和碱石灰组成的混合物,并把生成的氨气氧化成NO,再继续氧化成NO2,最后全部转化成HNO3。(反应过程中无损耗)求:
(1) 反应需标准状况下的氧气多少升?
(2) 可制得多少克硝酸?
答 案
一、1. B 2. C 3. C 4. C 5. D 6. B 7. D 8. D 9. D 10. B
二、11. C 12. D 13. C 14. B 15. A 16. A 17. C 18. D 19. D 20. D
三、21. ABCD
22. (1) c (2) c (3) (4) ; (5) 使N2、H2混合均匀;NH3、
四、23. 2,5,3—1,2,5,8;10NA;2.5
24. 升温;逆向;减小;分离C;逆向;液态或固态
25. (1) Al2O3;Fe2O3;Fe(OH)2 (2) 铝热剂 (3) Al3++3![]() +6H2O=4Al(OH)3;4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4) 4Fe(OH)2+O2+2H2O=4Fe(OH)3
+6H2O=4Al(OH)3;4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4) 4Fe(OH)2+O2+2H2O=4Fe(OH)3
六、26. (1) 以W浓度来表示的化学反应速率为
u(W)=![]() =0.02 mol / (L·min)
=0.02 mol / (L·min)
根据![]() =
=![]()
u(X)=0.02 mol / (L·min)×![]() =0.03 mol / (L·min)
=0.03 mol / (L·min)
(2) 根据![]() =
=![]()
n=![]() ×2=
×2=![]() ×2=1
×2=1
27. (1) n [(NH4)2SO4]=![]() =0.5 mol,
=0.5 mol,
根据(NH4)2SO4+Ca(OH)2![]() CaSO4+2H2O+2NH3↑
CaSO4+2H2O+2NH3↑
0.5 mol 1 mol
4NH3 + 5O2 = 4NO+6H2O
1 mol 1.25 mol 1 mol
4NO + 3O2 + 2H2O = 4HNO3
1 mol 0.75 mol 1 mol
V(O2)=(1.25 mol+0.75 mol)×22.4 L / mol=44.8 L
(2) m(HNO3)=1 mol×63 g / mol=63 g