第二章 第一节 化学反应速率 第一课时练习答案
一、 单项选择题
1、C 2、D 3、B 4、C 5、C
二、
6、B 7、B 8、CD 9、BD 10、C
三、 填空题
11、④>②=③>① 12、0.0025mol/(L·S) 13、①0.005mol/(L·S) ②1.2倍 ③1.6mol
14、0.24mol/L 15、⑴3X+Y![]() 2Z ⑵0.05mol/(L·min);0.04mol/(L·min)
2Z ⑵0.05mol/(L·min);0.04mol/(L·min)
⑶5min时,反应达到了平衡,各物质的反应速率不再改变,故5min后Z的生成速率与5min 末Z的生成速率相等。
第一节 化学反应速率 第二课时练习答案
一、 单项选择题
1、A 2、B 3、D 4、D 5、B
二、 选择题
6、AD 7、CD 8、D 9、CD 10、A
三、 填空题
11、0.08mol 12、C;大于 13、升高温度和使用催化剂。升高温度,反应物分子的能量增加,使一部分原来能量较低的分子变为活化分子;使用催化剂能够降低反应所需要的能量,从而使更多的反应物分子成为活化分子;因此,升高温度和使用催化剂都可以增大反应物分子中活化分子的百分数。 14、(1)2KCl O3+6NaHSO3==3Na2SO4+2KCl+3H2SO4,溶液中c(H+)增大,化学反应速率加快。(2)随着反应的进行,H2SO4和NaHSO3之间反应使H+及HSO3-浓度减小,后期化学反应速率减慢。 15、A的物质的量浓度 0.75 mol/L
1mol/L <C(B)<1.5 mol/L
第二节 化学平衡 第一课时练习答案
一、 单项选择题
1、C 2、B 3、C 4、B 5、D
二、 选择题
6、AC 7、AC 8、BD 9、CD 10、B
三、 填空题
11、②⑥⑨;⑥⑦⑧⑨⑩ 12、1.8mol 13、(1)v0=2.73×10-8 mol/(L•s)
(2)当I2消耗一半时,c(CH3COCH3)=0.1mol/L—1/2×0.01mol/L=0.095mol/L,c(H+)=0.1mol/L+1/2×0.01mol/L=0.015mol/L,此时的反应速率vt=2.73×10-5×0.095×0.015mol/(L•s)=3.89×10-8 mol/(L•s)显然 vt > v0,所以反应速率比开始时快。
第二节 化学平衡 第二课时练习答案
一、 单项选择题
1、A 2、B 3、D 4、D 5、B
二、 选择题
6、CD 7、D 8、AD 9、A 10、BC
三、 计算题
11、0.9倍 12、(1)30% (2)X=2 (3)1.15:1 13、(1)0.4mol/(L·S) (2)1.1mol/L
14、60%
第二节 化学平衡 第三课时练习答案
一、 单项选择题
1、D 2、D 3、B 4、C 5、C
二、 选择题
6、C 7、C 8、AD 9、CD 10、C
三、 填空题
11、(1)0.15mol/(L·S) (2)30% (3)17.6% (4)10g/mol 12、(1)④ (2)⑤
(3)① 13、①1.5a ②0;0.5 ③2(g-4m);ma 14、①2 ②2.25;0.5
③a+c/2=1或b+3c/2=3
第三节 影响化学平衡的条件 第一课时练习答案
一、 单项选择题
1、D 2、C 3、C 4、A 5、D
二、 选择题
6、C 7、AC 8、AB 9、AC 10、BD
三、 填空题
11、(1)2、1、3、2 (2) 气、固态或液态、气 (3)放
12、(1)定压容器、定压容器
(2)N2的转化率以及正反应速度都降低。
理由是:由于反应容器保持定压,所以当加入氩气后,反应容器的容积会增大,这样使得反应容器中的各物质的浓度降低,所以正反应速度降低(逆反应速度也降低),从反应物及产物的计量数可以看出,反应物的计量数比产物的计量数大,所以,容器容积增大对正反应速率降低的效果更为明显,故平衡向逆反应方向移动,使N2的转化率降低。
(3)①2 ②2.25 ; 0.5 ③3x=y ; 2x+z=2
13、(1)H2O H2, CO CO2 (2)(2-2a-b) mol
第三节 影响化学平衡的条件 第二课时练习答案
一、
 单项选择题
单项选择题
1、A 2、B 3、D 4、C 5、C
二、 选择题
6、AC 7、AC 8、AD 9、A 10、BC
三、 填空题
11、①正向 ②不移动 ③逆向 ④逆向 ⑤不移动
12、①向左 ②向右 ③不移动 ④不移动
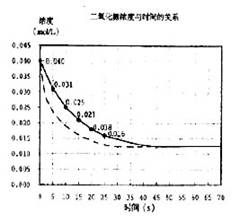
13、(1)5.5×10-4mol/(L·S) (2)图中实线
(3)图中虚线
14、(1)= (2)放 (3)<
第三节 影响化学平衡的条件 第三课时练习答案
一、 单项选择题
1、A 2、C 3、B 4、C 5、C
二、 选择题
6、AD 7、AD 8、A 9、AC 10、BC
三、 填空题
11、(1)V正>V逆;V正<V逆 (2)V正 (3)放热反应
12、(1)t0~t1;t2~t3;t5~t6 (2)t1升温;t3加催化剂;t4加压 (3)A
第三节 影响化学平衡的条件 第四课时练习答案
一、 单项选择题
1、A 2、B 3、D 4、A 5、B
二、 选择题
6、BC 7、AC 8、C 9、B 10、CD
三、 填空题
11、逆反应;稀释时水的浓度几乎不变,但单位体积内A、B、C、D微粒数均减小,根据勒夏特列原理,平衡应向微粒数增加的方向移动。
12、(1)770℃ 890℃ (2)降低压强或移走钾蒸气,适当升高温度。
13、(1)(1-a) (2)3a (3)2 3-3a 丁
(要考虑反应进行的程度问题)若3a>1,B的物质的量小于2mol;若3a=1,B的物质的量等于2mol;若3a<1,B的物质的量大于2mol
(4)![]() (5)乙
; 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
(5)乙
; 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
第四节 合成氨条件的选择 第一课时练习答案
一、 单项选择题
1、A 2、D 3、A 4、B 5、A
二、 选择题
6、BD 7、C 8、C 9、A 10、C
三、 填空题
11、(1)逆;压强增大2.5倍,而D浓度增大2.3倍,压强增大倍数大于D浓度增大的倍数。
(2)正;①加压,使物质E液化,引起平衡正向移动。②a>e
12、①啤酒瓶中CO2气体与啤酒中溶解的CO2达到平衡:CO2(g)
![]() CO2(aq),打开啤酒瓶,CO2气体压力下降,根据勒夏特列原理,平衡向放出CO2气体的方向移动,以减弱气体压力下降对平衡的影响。②温度是保持平衡的条件,玻璃杯的温度比冰镇啤酒的温度高,根据勒夏特列原理,平衡应向减弱温度升高的方向移动,即应向吸热方向移动,从溶液中放出CO2气体是吸热的,因而,应从溶液中放出CO2气体。
CO2(aq),打开啤酒瓶,CO2气体压力下降,根据勒夏特列原理,平衡向放出CO2气体的方向移动,以减弱气体压力下降对平衡的影响。②温度是保持平衡的条件,玻璃杯的温度比冰镇啤酒的温度高,根据勒夏特列原理,平衡应向减弱温度升高的方向移动,即应向吸热方向移动,从溶液中放出CO2气体是吸热的,因而,应从溶液中放出CO2气体。
13、25%
第四节 合成氨条件的选择 第二课时练习答案
一、 单项选择题
1、D 2、C 3、A 4、B 5、D
二、 选择题
6、AC 7、AC 8、C
三、 简答填空题
9、略。 10、升高温度或增大压力缩小体积
11、(1)气体体积缩小,溶液呈淡绿色 (2)气体和溶液均变为无色,最后气体的体积为20ml (3)氯水中存在化学平衡:Cl2+H2O![]() HCl+HClO,因HClO见光易分解(2HClO=2HCl+O2),使平衡右移,最后Cl2全转化为O2,且V (O2)=1/2 V (Cl2)
HCl+HClO,因HClO见光易分解(2HClO=2HCl+O2),使平衡右移,最后Cl2全转化为O2,且V (O2)=1/2 V (Cl2)
12、(1)3H2S+2Fe(OH)3=Fe2S3+6H2O (2)2.7n (3)b (4)生产纯碱(或作制冷剂等)
 (5)
(5)