《氮族元素》测试题2004届高考一轮复习检测题(三)
考试时间:120分钟 满分:120分 考试日期:2003.5.31 姓名_____________
可能用到的相对原子质量:H 1 N 14 O 16 Cu 64 Fe 56 Zn 65
第Ⅰ卷
一、选择题(每小题只有一个选项符合题意,每题4分,共60分)
1、下列变化中,属于物理变化的是( )
①红磷加热升华变成白磷 ②氯化铵晶体受热后由试管底部移到试管上部 ③固体碘受热变成碘蒸气 ④干冰汽化 ⑤浓硝酸从无色液体变成黄色液体
A ①② B ③④ C ④⑤ D ③④⑤
2、下列试剂:①浓HNO3 ②AgNO3 ③KNO3 ④氯水 ⑤氨水 ⑥NaHCO3应避光保存的是( )
A ①②③ B ④⑤⑥ C ①②④ D ②③⑥
3、经研究发现,有一种磷分子具有链状结构,如下图所示。下列说法不正确的是( )
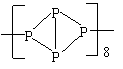 A 是一种极性分子,易溶于水
A 是一种极性分子,易溶于水
B 分子中每个磷原子以3个共价键与3个磷原子结合
C 相对分子质量8倍于白磷分子
D 它和白磷是磷的同素异形体
4、氨和酸反应生成铵盐的实质是( )
A 氨极易溶于水 B 氨具有碱性
C 氨分子与H+形成铵离子 D 氨分子是极性分子
5、人体正常的血红蛋白中应含Fe2+,若食亚硝酸盐,则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸盐中毒,下列叙述可能正确的是( )
A 亚硝酸盐是还原剂 B 维生素C是氧化剂
C 亚硝酸盐被氧化 D 维生素将Fe3+还原成Fe2+
6、氢叠氮酸HN3与氢卤酸相似,它是易挥发的弱酸,下列叙述中不正确的是( )
A 它的水溶液中存在着N3-离子 B 是无色、有刺激性气味的气体
C NaN3与稀硫酸作用生成HN3 D 它与氨作用生成的是共价化合物
7、砷(As)在元素周期表中位于ⅤA族,且As2S3与As2O3性质相似,均具有还原性,Na2S2与Na2O2性质相似,均具有氧化性。当As2S3与Na2S2相互反应时,所得产物是( )
A Na3AsS3 B NaAsS4 C Na3AsS4 D Na2AsS4
8、已知亚磷酸(H3PO3)只能生成两种钠盐(NaH2PO3和Na2HPO3),由此可知不正确的说法是
A 亚磷酸中磷呈+3价 B 亚磷酸有氧化性和还原性 ( )
C 亚磷酸是二元酸 D 亚磷酸只形成两种酸式盐而无正盐
9、标准状况下,在三个干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4:1),然后分别以水作溶剂作喷泉实验。实验结束后三个烧瓶中所得溶液的物质的量浓度之比为( )
A 2:1:2 B 5:5:4 C 1:1:1 D 无法确定
10、将3. 84克铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体2.24L(标况下),则所消耗硝酸的物质的量是( )
A 0.11mol B 0.22mol C 0.16mol D 0.1mol
11、已知碱能除去硝酸尾气:NO + NO2 + 2NaOH = 2NaNO2 + H2O,根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液吸收的是( )
A 1molO2和4molNO2 B 1molO2和4molNO
C 1molNO和5molNO2 D 4molNO和1molNO2
![]() 12、工业废气NO、NO2是造成大气污染的气体之一,工业上常用原理:NOx
+ NH3
N2 + H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是( )
12、工业废气NO、NO2是造成大气污染的气体之一,工业上常用原理:NOx
+ NH3
N2 + H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是( )
A 1:1 B 2:1 C 3:1 D 1:3
13、将充有n mLNO和m mLNO2气体的试管倒立于盛水的水槽中,然后通入n mLO2。m>n,则充分反应后,试管中气体在同温同压下的体积为( )
A (m-n)/3 mL B (n-m)/3 mL C (4 m-1)/13 mL D 3/(m-n) mL
14、某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入2.56克Cu粉,待充分反应后,溶液中Cu2+物质的量浓度为( )
A 0.15mol/L B 0.3mol/L C 0.225mol/L D 无法计算
15、欲检验一瓶中装的是稀氨水,现用一沾有浓盐酸的玻棒靠近瓶口,为了使现象明显,可事先往瓶中加入下列哪种物质 ①浓H2SO4 ②固体烧碱 ③固体P2O5 ④生石灰 ⑤固体NH4Cl ⑥固体食盐 ( )
A ①② B ②④ C ②④⑤ D ①③⑥
第一卷答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
第Ⅱ卷
二、填空(24分)
16.(8分)一无色气体,可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成。将此无色气体通过盛有浓H2SO4的洗气瓶,发现气体体积减少。继续通过装有固体Na2O2的干燥管,发现从出气管出来的气体颜色显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍然为一满试管液体。由此可推知:①原气体中一定含有_____________,一定不会有 ____________;②最终结果可知原气体中_____________气体的体积比为_______。
17.(8分)NO分子对空气会造成污染。近年来发现少量的NO在生物体内许多组织中存在。它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学研究的热点。请回答下列问题:
(1)NO对环境危害在于_______________
A 破坏臭氧层 B 高温下使一些金属氧化
C 造成酸雨 D 与人体血液中血红蛋白结合造成缺氧
(2)在含Cu+的酶的活化中心中,亚硝酸离子( NO2-)可转化为NO。写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:___________________________________________。
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到500C,发
现气体的压力迅速下降,但压力降至略小于原压力的2/3就不再改变。已知其中一种产物
为N2O,试写出上述变化的化学方程式:________________________________________。
(4)用化学方程式解释(3)中为什么最后的气体总压力小于原压力的2/3?_____________
18.(8分)(1)m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m : n = 1 : 2.7,该反应
的化学方程式为__________________________________________________________(假设还原
产物只有一种,且只生成一种盐)(3分)
(2)含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4 gHNO3被还原成NO(无其它还原产物)则 n 的范围为_________________________(3分)
(3)某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是____________
三、实验题(10分)
19.实验室合成氨装置如图:
 |
试回答:
(1)装置甲的作用是:①_______________________,②_____________________________,
(2)从丙导出的气体是_______________,
(3)乙中发生的反应方程式为________________________________________,
(4)检验产物的简单化学方法是__________________________________________________。
四、推断题(8分)
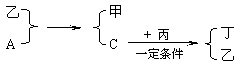 20.A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
20.A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
试回答:
(1)丙的电子式为___________________
(2)A和乙,单质C和丙所发生反应的化学方程式分别为______________________________,
_______________________________________
(3)丙和丁能否在一定条件下反应?_________(填能或不能)。
五、计算题(18分)
![]() 21、(6分)ABS工程树脂,是由丙烯腈( CH2=CHCN,符号A)、1,3丁二烯( CH2=CHCH=CH2,符号B)和苯乙烯(
-CH=CH2,符号S)按一定配比共聚而得。
21、(6分)ABS工程树脂,是由丙烯腈( CH2=CHCN,符号A)、1,3丁二烯( CH2=CHCH=CH2,符号B)和苯乙烯(
-CH=CH2,符号S)按一定配比共聚而得。
(1)A、B和S三种单体中,碳氢比(C:H)值最小的单体是(填符号)______________
(2)经元素分析可知该ABS样品的组成为CaHbNc(a b c 为正整数),则原料中A和B的物质的量之比是_______________(用a b c的代数式表示)
22、(12分)铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物为NH4+,请分析下图,回答有关问题。
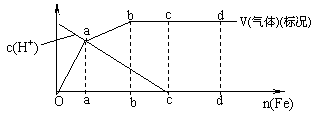 |
(1)
![]() 在任一气体产物的曲线内只有一种还原产物,试配平由b 点到 c 点时的反应的化学方
在任一气体产物的曲线内只有一种还原产物,试配平由b 点到 c 点时的反应的化学方
程式
Fe + HNO3 = Fe(NO3)3 + + H2O
(2)判断从O点到 a 点时的还原产物为_________________
(3)a 点到 b 点时产物产生的还原产物为________,其原因是________________________
____________________________________________________
(4)已知达到 d 点时反应完全结束,此时溶液中的主要阳离子为______________________,
分析投入金属铁的物质的量之比 nc (Fe)/nd (Fe) = _______________________。
《氮族元素》测试题答案2004届高考一轮复习检测题(三)
一、选择题答案:
1 B 2 C 3 A 4 C 5 D 6 D 7 C 8 D 9 B 10 B 11 D 12 D 13 A 14 B 15 C
*7。As2O3中O为-2价,As为+3价;Na2O2中O为-1价,有氧化性,能将+3氧化为+5价,自身被还原为-2价,故产物为Na3AsO4,As2S3与Na2S2与此类似)
10 用守恒法解。11 由方程式可知,只要能使NO和NO2的体积比为1:1就能完全吸收。
12 根据化合价升降总数相等计算。14、根据离子方程式进行计算。
二、填空题
16 ① NH3、NO、CO2,NO2、HCl、H2 ②NO和CO2,2:3
![]() 17 (1) A、C、D, (2)Cu+ + NO2- + 2H+ = Cu2+ + NO↑ + H2O
17 (1) A、C、D, (2)Cu+ + NO2- + 2H+ = Cu2+ + NO↑ + H2O
![]() (3) 3NO
N2O + NO2 2NO2 N2O4
(3) 3NO
N2O + NO2 2NO2 N2O4
18 (1) 5Fe + 12HNO3 = 5Fe(NO3)3 + N2 + 6H2O (由质量比求出物质的量之比,再根据得失电子总数相等来计算)
(2)16.8 ≤ n ≤ 25.2 (分别讨论生成+2、+3价铁的硝酸盐两种情况,利用得失电子数相等)
(3)N2O或NH4NO3 (根据化合价升降总数相等来计算)
三、实验题
![]() 19 (1)①干燥N2和H2 ②使N2和H2混合均匀 ③便于观察和控制N2和H2和通入量
19 (1)①干燥N2和H2 ②使N2和H2混合均匀 ③便于观察和控制N2和H2和通入量
(2)NH3、N2、H2 (3)N2 + 3H2 2NH3
|
![]()
|
|
|
|
(3)能。(6NO + 4NH3 = 5N2 + 6H2O,根据NO、NH3中N的化合价判断,NO2与NH3也能反应,二者都属化合价归中反应)
五、计算题
21 (1)B (A、B、C中C:H值分别是1:1、4:6 = 2:3、1:1) (2)c:(b-a)/2
[(2)方法一:由氮原子守恒可知,平均每个分子中含有c个A分子,设含B、C分子分别为X、Y。根据C、H守恒分别有:3c + 4X + 8Y = a,3c + 6X + 8Y = b,解得X =(b-a)/2。
方法二:(由分子式可知,ABS分子中含有c个A分子,由A、B、C的分子式可知,只有B分子中氢原子数比碳原子多2,因此,ABS分子中氢原子数比碳原子数多2个,必含一个B分子)]
![]() 22(1) Fe + HNO3 = Fe(NO3)3
+
+ H2O
22(1) Fe + HNO3 = Fe(NO3)3
+
+ H2O
(b到c之间,由于反应已进行了一段时间,硝酸的浓度变得很稀,因此还原产物为NH4+,且此时气体的体积不变,所以产物应为NH4NO3 (2)NO
(3)N2O,铁与稀硝酸的反应为放热反应,随着反应的进行,溶液的温度逐渐升高。
(4)Fe2+、NH4+,2:3
(在c点时,硝酸已消耗完,以后发生的反应是:2Fe3+ + Fe = 3 Fe2+,此时消耗的Fe为a到c之间Fe的一半)