桃源一中高二化学《化学平衡》测试题
2006年9月
一、选择题(每题有1~2个选项符合题意,每小题2分,共44分。)
1.一定条件下反应N2(g)+3H2(g) ![]() 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
2.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是
A 、 反应混和物的浓度 B 、 反应物的转化率
C 、 正、逆反应速率 D 、 反应混和物的压强
3.能够充分说明在恒温下的密闭容器中,反应 2SO2 + O2 ![]() 2SO3 已经达到平衡状态的标志是( )
2SO3 已经达到平衡状态的标志是( )
A.SO2、O2、SO3的物质的量之比为2:1:2 B.SO2和SO3的浓度相等
C.容器中SO2、O2和SO3共存 D.反应器内压强不再随时间发生变化
4.在2A+B ![]() 3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) = 0.3 mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)= 1 mol·L-1·S-1
5.能增加反应物分子中活化分子的百分数的是
A.降低温度 B.使用催化剂 C.增大压强 D.增加浓度
6.可逆反应N2+3H2![]() 2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是
2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是
A.3v正(N2)= v正(H2) B.v正(N2)= v正(NH3)
C.2v正(H2)=3 v逆(NH3) D.v正(N2)=3 v逆(H2)
7.在2L的密闭容器中,发生3A(g)+B(g) ![]() 2C(g)的反应,若最初加入A和B都是4mol,10s后,测得υ(A)=0.12mol·(L·S)-1,则此时容器中B的物质的量是
2C(g)的反应,若最初加入A和B都是4mol,10s后,测得υ(A)=0.12mol·(L·S)-1,则此时容器中B的物质的量是
A.3.6mol B.3.2mol C.2.8mol D.1.6mol
8.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是
A.2NO+O2![]() 2NO2 B.Br2(g)+H2
2NO2 B.Br2(g)+H2
![]() 2HBr
2HBr
C.N2O4
![]() 2NO2
D.6NO+4NH3
2NO2
D.6NO+4NH3 ![]() 5N2+3H2O
5N2+3H2O
9.在某温度下,反应ClF(g)+F2(g) ![]() ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是( )
ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是( )
A.温度不变,缩小体积,ClF的转化率增大
B.温度不变,增大体积,ClF3的产率提高
C.升高温度,增大体积,有利于平衡向正反应方向移动
D.降低温度,体积不变,F2的转化率降低
10.硫代硫酸钠(Na2S2O3)与稀H2SO4溶液作用时,发生如下反应:
Na2S2O3+H2SO4==Na2SO4+SO2+S↓+H2O
下列化学反应速率最大的是
A.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水5mL,反应温度10℃
B.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度10℃
C.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃
D.0.2mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30
![]() 11.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则
11.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B. 物质B的质量分数增加了
C.物质A的转化率减小了 D.a>b
12.已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加 ③反应物转化率一定增大 ④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②⑤ C.③⑤ D.④⑥
13.在一固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:
2NO2(g)![]() N2O4,此时平衡混合气体中NO2的体积分数为x%;若再充入1mol
N2O4,在温度不变的情况下,达到新平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
N2O4,此时平衡混合气体中NO2的体积分数为x%;若再充入1mol
N2O4,在温度不变的情况下,达到新平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
A.x>y B.x=y C.x<y D.不能确定
14.下列事实中,不能用列夏特列原理解释的是
A.溴水中有下列平衡:Br2+H2O![]() HBr+HBrO, 当加入AgNO3溶液后溶液颜色变浅
HBr+HBrO, 当加入AgNO3溶液后溶液颜色变浅
B.对二氧化硫的品红溶液加热可使颜色变深
C.反应CO+NO2![]() CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
D.合成氨反应N2+3H2![]() 2NH3(正反应放热)中使用催化剂
2NH3(正反应放热)中使用催化剂
15.在1L密闭容器中通入2mol氨气,在一定温度下发生反应;2NH3 ![]() N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是
N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是
A.6mol H2和2mol N2 B.2mol NH3和1mol N2
C.2mol N2和3mol H2 D.0.1mol NH3、0.95mol N2、2.85mol H2
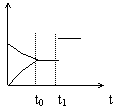 16.如图是表示:2X+Y
16.如图是表示:2X+Y ![]() Z+R+Q的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
v
Z+R+Q的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
v
A.减少Z物质
B.加大压强
C.升高温度
D.使用催化剂
17.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2 ![]() 2SO3,平衡时SO3为n
mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
2SO3,平衡时SO3为n
mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
A.1 mol SO2+1 mol O2 +1 mol SO3 B.4 mol SO2 + 1 mol O2
C.2 mol SO2+1 mol O2 +2 mol SO3 D.2 mol SO2 + 1 mol O2
18.下列说法中正确的是
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态
D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
19.一定温度下,可逆反应A2(g)+3B2(g) ![]() 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
A.容器内每减少1mol A2,同时生成2mol AB3
B.容器内每减少1mol A2,同时生成3mol B2
C.容器内A2、B2、AB3的物质的量之比为1:3:2
D.容器内A2、B2、AB3的物质的量浓度之比为1:1:1
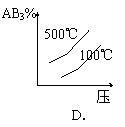 20.对于可逆反应 2AB3(g)
20.对于可逆反应 2AB3(g)
![]() A2(g) + 3B2(g)
- Q,下列图像正确的是
A2(g) + 3B2(g)
- Q,下列图像正确的是
 | 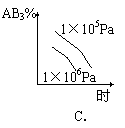 | | ||||
21.在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g) ![]() 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为
2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为
A.67% B.50% C.25% D.5%
22.化学反应速率υ和反应物浓度的关系是由实验方法制定的.化学反应H2+Cl2=2HCl的反应速率υ=K[c(H2)]m·[c(Cl2)]n,式中的K为常数,m、n值可用下表中的数据确定出:
| c(H2)mol·L-1 | c(Cl2)(mol·L-1) | v(molL-1·S-1) |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
由此可推得m、n值正确的是( )
A.m=1,n=1 B.m=0.5,n=0.5 C.m=0.5,n=1 D.m=1,n=0.5
桃源一中高二化学《化学平衡》测试题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
二、填空题(共44分)
23. (6分)把 3mol A 和 2.5mol B 混合于 2L 的密闭容器中,使它们发生反应:
3A(气) + B(气) ![]() xC(气) + 2D(气)
xC(气) + 2D(气)
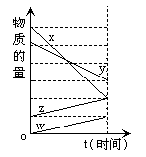

24.(2分)下图表示在某温度下经时间t反应后,物质 X、Y、Z、W 的物质的量的大致变化情况。则所发生反应的化学方程式是__________________________________
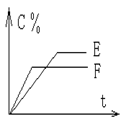 25. (6分) mA(气) + nB(气)
25. (6分) mA(气) + nB(气) ![]() pC(气) + qD(气) 的 C % 与时间 t 有如图关系
pC(气) + qD(气) 的 C % 与时间 t 有如图关系
(1)若E、F表示两种温度,则 E____F ( 填 > 、< 或 = ),正反应____ 热
(2)若E、F表示两种压强,则 m + n_____p + q
26.(4分)K2Cr2O7是橙红色晶体,K2Cr2O4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,可以发生的离子反应方程式为:Cr2O2-7+H2O![]() 2CrO2-4+2H+,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
2CrO2-4+2H+,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
(1)向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,则试管中的溶液呈 色.原因是 .
(2)向(1)所得的溶液中滴入5滴2mol·L-1的硫酸,试管中溶液呈 色,理由是 .
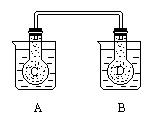 27. (2分)如图所示,在常况下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有
500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向
A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入 10g 苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶 C 和
D 中气体的颜色变化是______
27. (2分)如图所示,在常况下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有
500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向
A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入 10g 苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶 C 和
D 中气体的颜色变化是______
① 不变 ② 烧瓶 C 中颜色变深,D 中变浅
③ 烧瓶 D 中变深, C 中变浅 ④ 两个烧瓶中的颜色都变深
28.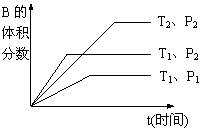 (4分)已知某可逆反应mA(g)+nB(g)
(4分)已知某可逆反应mA(g)+nB(g) ![]() qC(g)在密闭容器中进行。如图所示
qC(g)在密闭容器中进行。如图所示
反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
(⑴、⑵、⑶题填“>”、“<”或“=”):
⑴温度的关系:T1________T2;
⑵压强的关系:P1________P2;
⑶化学计量数的关系:m+n______q;
⑷该反应的正反应为___________反应。(填“吸热”或“放热”)
29. (8分)某反应A+B![]() C在任一时刻的正、逆反应速率都可用υ正、υ逆表示:υ正=k1·c(A)·c(B),υ逆=k2·c(C),其中k1、k2在一定温度下恒为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度.
C在任一时刻的正、逆反应速率都可用υ正、υ逆表示:υ正=k1·c(A)·c(B),υ逆=k2·c(C),其中k1、k2在一定温度下恒为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度.
(1)上述反应达到平衡时,三种物质的物质的量浓度关系可表示为 .
(2)在300K时,开始反应的A、B浓度均为0.1mol·L-1,达平衡时B的转化率为50%,则 k1、k2之间的关系是 .
(3)升高温度,k1、k2的变化是 ,k1/k2增大,说明正反应是 (填“吸”或“放”)热反应.
30.(12分)有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒
压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1
的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下
使之发生如下反应:2SO2+O2![]() 2SO3。试填写下列空格:
2SO3。试填写下列空格:
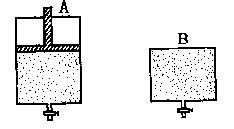 |
(1)A容器达到平衡时所需的时间比B容器_________;平衡时A容器中SO2的转化率比B容器_______;
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等物质的量的氩气,A容器中化学平衡__________________移动,B容器中化学平衡_______________移动;
(3)达到(1)所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
三、计算题(12分)
31.(6分)在合成氨时,将1体积氮气和3体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少?
32. (6分)在一个固定容积的密闭容器中,保持一定温度进行以下反应:
H2(g) + Br2(g) ⇌ 2HBr(g)
已知加入2 mol H2和1molBr2,达到平衡时生成a mol HBr(见表已知项)。在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①~③的状态,填写表中的空白:
|
| 起始状态物质的量(mol) | 平衡时HBr物质的量(mol)
| ||
| H2 | Br2 | HBr | ||
|
| 2 | 1 | 0 | a |
| ⑴ | 4 | 2 | 0 |
|
| ⑵ |
|
| 1 | 0.5 a |
| ⑶ | m(m≥2n) | n |
|
|
桃源一中高二化学《化学平衡》测试题
参考答案
一、选择题(共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 选项 | C | B | D | B | B | C | B | B | A | D | B |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 选项 | B | A | D | D | D | C | D | B | B | B | D |
二、填空题(共26分)
23 20% ;2 ;0.75mol/L
24.4X + 2 Y == W + Z
25. (1) E < F ;放 (2) m + n < p + q
26.17.(1)黄色;加入OH-,使H+减少,平衡向右移动,[CrO2-4]增大 (2)橙黄之间;加入H2SO4的物质的量与NaOH恰好中和,使平衡恢复原状态
27.③
28、(12分)
⑴ > ⑵ < ⑶ < ⑷ 吸热
29..(1)![]() =
=![]() (2)
(2) ![]() =20 (3)均变大;吸
=20 (3)均变大;吸
30.(12分)
(1)短; 高(或大)
(2)向逆反应方向; 不
(3)不变; 增大。
三、计算题:(10分)
31.N2 22% , H2 66%
32.(1) 2a
(2) 0.5 0
(3)2m-4n (m - n)a