高二化学选修3第一二章测试题
考试时间:100分钟 卷面分数:120分
可能用到的相对原子质量:
H: 1 C:12 N: 14 O: 16 Na:23 Mg: 24 Al:27 Cl: 35.5 Fe:56 Cu: 64 Zn: 65
第 Ⅰ 卷(选择题 共63分)
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
1.有关乙炔分子中的化学键描述不正确的是
A.两个碳原子采用sp杂化方式
B.两个碳原子采用sp2杂化方式
C.每个碳原子都有两个未杂化的2p轨道形成π键
D.两个碳原子形成两个π键
2.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中
常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤对电子
B.PH3是非极性分子
C.PH3是一种强氧化剂
D.PH3分子的P-H键是非极性键
3.下列物质中,难溶于CCl4的是
A.碘单质
B. 水
C. 苯
D.甲烷
4.x 、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由
此可知
A.x的原子半径大于y的原子半径。 B.x的电负性大于y的电负性
C.x阴离子的半径小于y阳离子的半径 D.x的第一电离能小于y 的第一电离能
5.某元素的原子最外电子层排布是5s25p1,该元素或其化合物不可能具有的性质是
A.该元素单质是导体 B.该元素单质在一定条件下能与盐酸反应
C.该元素的氧化物的水合物显碱性 D.该元素的最高化合价呈+5价
6.下列分子或离子中,含有孤对电子的是
A.H2O
B.CH4
C.SiH4
D.NH4+
7.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
8.按能量由低到高的顺序排列,正确的一组是
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p
9.最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在—268℃时冻结分子的
热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。
下列化合物分子中一定既含单键又含双键的是
A.CO2
B.C2H4O
C.COCl2
D.H2O2
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个
且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
10.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
11.基态原子的4s能级中只有1个电子的元素共有
A.1种 B.2种 C.3种 D.8种
12.下列各组分子中,都属于含极性键的非极性分子的是
A. CO2 H2S
B. C2H4 CH4
C. C60 C2H4
D.NH3 HCl
13.若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是
A.该元素原子处于能量最低状态时,原子中共有3个未成对电子
B.该元素原子核外共有5个电子层 C.该元素原子的M能层共有8个电子
D.该元素原子最外层共有3个电子
14.根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
15.A原子的结构示意图为![]() 。则X、Y及该原子3p能级上的电子数分别为
。则X、Y及该原子3p能级上的电子数分别为
A.18、6、4 B.20、8、6 C.18、8、6 D.15~20、3~8、1~6
高二化学选修3第一二章测试题
班级 姓名 学号 得分
16.下图中,能正确表示基态硅原子的是
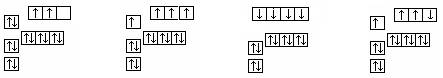
A B C D
17.下列分子或离子中不能跟质子结合的是
A.NH3 B.H2O
C.Ca2+ D.NH4+
18.据权威刊物报道,1996年科学家在宇宙中发现H3分子。甲、乙、丙、丁四位学生对此报
道的认识正确的是
A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论
B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体
C.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+
D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第 Ⅱ 卷(非选择题 共57分)
19.(6分)2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。
运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为 。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出
该反应的化学方程式 。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述
氮氢化合物通入足量盐酸时,发生反应的化学方程式
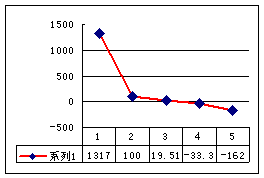
20.(8分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

请回答以下问题:
⑴ 认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵ 从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________
_____________________________;
⑶ 上图中5号元素在周期表中的位置是_____________、_______________;
⑷ 上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
21.(7分)X原子在第二电子层上只有一个空轨道,则X是 ;其轨道表示式为 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 ;Y原子的核电荷数为33,其外围电子排布是 ,其在元素周期表中的位置是 ,是属于 区的元素。
22.(12分)已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:
(1)若X、Y均为非金属元素,写出你所知道的XY2的化学式____________________、
______________________、____________________、_______________________等。
(2)若X原子的外围电子层排布为3d104s2,Y可能是____________元素或 ___________
元素(写元素符号)。
(3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:
_____________________、_______________________、_____________________、
_____________________、_______________________、_____________________。
23.(5分)A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子
序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电
子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。
(1)它们的元素符号分别为:A ;B ;C ;
(2)BC2是由 键组成的 (填“极性”或“非极性”)分子。
24.(11分)氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+
与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式 。
⑵NH2-的电子式为 。 ⑶N3-有 个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式 。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型 。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
 25. (8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
25. (8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。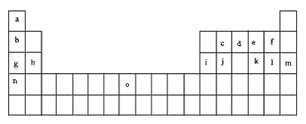
试回答下列问题
(1)元素“O”在周期表中的位置是 。
 (2)画出“c”的简化电子排布式 。
(2)画出“c”的简化电子排布式 。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表 (填字母,下同),“7”代表 。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐
标图如右,序列“5”氢化物的化学式为:
;序列“1”氢化物的电子式为: 。
高二化学选修3第一二章测试题参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | A | B | B | D | A | C | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | C | B | C | C | B | A | CD | D |
19.(共6分)
![]() H H
H H
(1)H:N:N:H (2分)
(2)N2H4+2H2O2=N2+4H2O (2分)
(3)N2H4+2HCl=N2H6Cl2 (2分)
20 .(每小题2′,共8′)⑴见上图(右)
⑵从上到下依次减小; ⑶第三周期,ⅤA族;
⑷因同主族上一周期的元素的氢化物分子间存在氢键
21.C,略;Al,Cl;As 4S24P3,第四周期ⅤA,P区。
22.(1)CO2 SO2 SiO2 CS2 (2)F、Cl (3)1s2 2s2 3s2 4s2 3d64s2 3d94s2 3d104s2
23.(1)H; C; S;(每空1分)
(2)极性;非极性(每空1分)
24.⑴N2H62++2OH-=N2H4+2H2O(2分)
⑵![]() (2分)
(2分)
⑶22 (1分)
⑷N2O CO2 CNO- BeF2 CaH2 C3H4等 (两空各6分)
[说明]可将N3-中“N-”换为O得到N2O,还可进行类似变换得到其他等电子体。
⑸直线型(1分)
⑹一个单位正电荷 (1分)
25.(1)第4周期第Ⅷ族; (2)[He]2s22p2
(3)m;i;
(4)CH4;
![]()