龙东南六校联考高二化学期末试卷
出题:高 波 审核:马丛岩
本试卷分第Ⅰ卷共60分,第Ⅱ卷共40分,满分100分,考试时间90分钟。
第Ⅰ卷 选择题
可能用到的相对原子质量:
H-1 He-4 C-12 N-14 O-16 Na-23 Mg-24 A1-27 S—32 C1-35.5 K-39 Ca-40 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137
一、选择题(每小题只有一个正确答案,每小题3分,共45分。)
1.下列叙述中正确的是 ( )。
A.含金属元素的离子都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂,金属单质一定是还原剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
2.随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是( )。
A.利用电池外壳的金属材料
B.回收其中石墨电极
C.防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D.不使电池中泄漏的电解液腐蚀其他物品
3.常温下,能在铁制容器中贮存的物质是( )。
A.浓盐酸 B.氯化铁溶液 C.浓硫酸 D.硫酸铜溶液
4.下列各组离子在溶液中能大量共存的是( )。
A. Ca2+,HCO3—,Cl-,K+ B. Al3+,AlO2—,HCO3—,Na+
C. Fe2+,NH4+,SO42-,S2- D. Fe3+,SCN—,Na+,CO32-
5.把6molA和5molB两气体通入容积为4L的密闭容器中,在一定条件下发生如下反应:3A(g)+B(g)![]() 2C(g)+xD(g);正反应方向为放热,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是 ( )。
2C(g)+xD(g);正反应方向为放热,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是 ( )。
A.降低平衡体系的温度,逆反应速率变小,正反应速率增大,平衡正向移动
B.恒温下达到平衡的标志是C和D的生成速率相等
C.A的平均反应速率为0.15mol·(L·min)-1
D.B的转化率为25%
6.某温度下,在容积可变的容器中,反应2A(g)+B(g) ![]() 2C(g)达到平衡时,A、
2C(g)达到平衡时,A、
B和C的物质的量分别为4mol,2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向左移动的是 ( )。
A.均减半 B.均加半 C.均增加1mol D. 均减少1mol
7.下列离子方程式正确的是( )。
A.Fe2O3溶于过量的氢碘酸中 Fe2O3+6H+=2Fe3++3H2O
B.氯化铝溶液中加入足量的氨水: Al3++3OH-=Al(OH)3↓
C. FeBr2溶液中加入过量的氯水 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.铝和烧碱溶液: 2Al+2OH-+2H2O=2AlO2-+3H2↑
8.草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是( )。
A.c(K+)+c(H+)=c(HC2O4—)+c(OH—)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C.c(C2O42—) < c(H2C2O4) D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42—)
9.A、B、C、D、E分别是Cu、Ag、Fe、Al、Mg五种金属中的一种,已知:①A、C均能与稀H2SO4反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体;④C、E在冷浓硝酸中发生钝化,由此可判断A、B、C、D、E依次为 ( ) 。
A. Fe、Cu、Al、Ag、Mg B. Al、Cu、Mg、Ag、Fe
C. Mg、Cu、Al、Ag、Fe D. Mg、Ag、Al、Cu、Fe
10. 下列物质的制备方法正确的是 ( )。 A.用金属钠和氯化钾溶液反应制备金属钾
B.用镁粉和二氧化碳反应可以制备炭粉
C.用铝粉和软锰矿(含MnO2)反应可制得锰
D.用镁粉和空气反应可制得Mg3N2
|
A.AgNO3 B.NH3 H2O C.NaOH D.BaCl2
12.分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出的H2量前者多,其原因可能是( )。
①两溶液的体积相同,酸是多元强酸 ②两溶液的体积相同,酸是一元弱酸③酸溶液的体积大于NaOH溶液的体积 ④ 酸是强酸,浓度比NaOH溶液的大
A、①② B、②③ C、② D、④
13.如图所示,把A、B插入C的溶液中,闭合电键后电流表的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质( )。
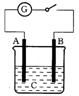 A.A—Cu B—Zn C—
A.A—Cu B—Zn C—![]()
B.A—Ag B—Fe C—HCl
C.A—Zn B—石墨 C—![]()
D.A—石墨 B—Zn C—![]()
14.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )。
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
15.下列各组物质混合之后,可生成amol沉淀的是 ( )。
A.含amol NaAlO2溶液与amol CO2气体
B.含amol NaAlO2溶液与含amol AlCl3溶液
C.含amol AlCl3溶液与含amol Ba(OH)2的溶液
D.含amol AlCl3溶液与含amol NaOH的溶液
二、选择题(每小题有一至两个正确答案,每小题3分,若有两个答案只答对一个且只答一个的得2分,全对的得3分,其余不得分。共15分。)
16.拉曼光谱证实,溶液中不存在AlO2—,实际存在[Al(OH)4] —,0.2mol/L Na[Al(OH)4]溶液200mL与0.2mol/L 250mLH2SO4混合完全反应后,溶液中Al3+与SO42—物质的量之比( )。
A、4:5 B、2:3 C、2:5 D、1:2
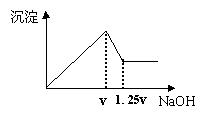 17.有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入
17.有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入
NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系
如图所示,则溶液中c(Cl‑)与c(SO42-)之比为( )。
A.1∶1 B.2∶3
C.3∶2 D.2∶1
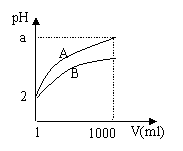 18.PH=2的A、B两种酸溶液各1ml,分别加水稀释
18.PH=2的A、B两种酸溶液各1ml,分别加水稀释
到1000ml,其溶液的PH与溶液体积﹝V﹞的关系
如右图所示,则下列说法正确的是( )。
A、A、B两种酸溶液的物质的量浓度一定相等
B、稀释后A酸溶液的酸性比B酸溶液的强
C、a=5 时,A是强酸,B是弱酸
D、若A、B都是弱酸,则5>a >2
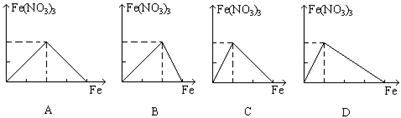
19、下列图象是表示铁跟一定量硝酸反应时, 铁和硝酸铁之间物质的量(mol)的关系, 其中正确的是( )。
20、在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+。则下列判断正确的是( )。
A、混合物里三种物质反应时,消耗盐酸的物质的量之比为1:1:3
B、反应后所得溶液中Fe2+与Cl—物质的量之比为1:2
C、混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D、混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
第Ⅱ卷 非选择题
三、填空题(本题包括三个小题,共18分。)
21.(3分)烟幕弹是一种在战争中常用的掩护武器,制造烟幕弹需要用到一些化学物质.
(1)用红磷作烟幕弹时,反应化学方程式为__________________
(2)有些烟幕弹产生烟幕的原理应用了水解反应.水解反应是一类广泛存在的反应,如![]() 、
、![]() 易水解.
易水解.![]() 的水解反应为:
的水解反应为:![]() .现代海战中,常常通过喷放
.现代海战中,常常通过喷放![]() 和液氨产生大量烟幕,所涉及反应的化学方程式为__
和液氨产生大量烟幕,所涉及反应的化学方程式为__
_________________________________________________________________
22.(6分)已知某溶液中含有4种离子:A+、B一、H+、OH一,对这4种离子浓度的大小比较,有以下3种说法。请判断离子浓度大小顺序是否正确,你认为正确的请在相应的空格内填上符合这种情况的A+和B-组成物质的化学式(只写一种情况,可以是一种溶质,或两种溶质);你认为一定不正确的,请在相应的空格内填上你选择“不正确”的理由。供选择的离子有:Na+、Ag+、NH4+、Cl-、NO3-、CH3COO-、H+、OH-
(1)c(B- )c>c(A+)>c(H+)>c(OH- ):
(2)c(A+)>c(B- )>c(OH- )>c(H+):
(3)c(H+)>c(B- )>c(A+)>c(OH-):
23、(9分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
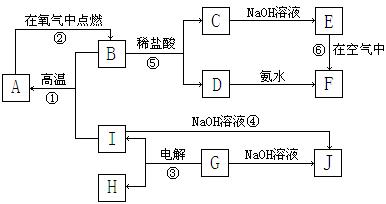 |
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置_________。
(2)写出C、G物质的化学式。C. G.
(3)写出①、④、⑥反应的化学方程式。
反应①:___________________________________________________________
反应④:___________________________________________________________
反应⑥:___________________________________________________________
(4)从能量变化的角度看,①②③反应中属于放热的反应是_____。(填序号)
四、实验题(共10分)
24.(10分)准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.01mL | 18.60mL |
| 第二次 | 0.20mL | 18.00mL |
①(2分)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.01)
②(1分)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3测出的盐酸浓度 (填“偏高”、“偏低”或不变”)。
③(2分)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
④(2分)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? (填 “是”或“否”)
⑤(3分)25℃,pH=x的盐酸aL与pH=y的NaOH溶液bL恰好中和(x≤6、y≥8)。
(1)若x+y=12,则![]() =
=
(2)若x+y >14,则![]() =
(用x、y表示)且a b(“>”“<”“=”)
=
(用x、y表示)且a b(“>”“<”“=”)
五、计算题(共12分)
25.(6分)某铝热剂仅由两种物质组成,把一定质量的该铝热剂加入到过量的稀H2SO4中充分反应后收集到H2 11.2L。将同样质量的铝热剂隔绝空气加热后恰好充分反应,待冷却后,将生成物投入足量的稀H2SO4中充分反应收集到H2 8.4L,溶液中再加入过量NaOH充分反应后有白色沉淀生成,该沉淀放置过程中变浅绿色,最后变为红褐色。计算说明该铝热剂的组成。
26.(6分)将22g铁粉和氧化铁的混合物加入到某浓度的稀硫酸200ml中,充分搅拌,使之完全反应,共收集到H2 3.36L(标准状况),反应结束后溶液中还剩下2.8g铁粉。
求:(1)原混合物中铁粉和氧化铁的物质的量之比。
(2)原稀硫酸的物质的量浓度。
龙东南六校联考高二化学期末试题
参考答案
第Ⅰ卷 选择题
一、选择题(共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | C | C | A | C | D | D | D | C | C | C | B | C | C | A |
二选择题(共15分)
| 题号 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | B | CD | C | BC |
第Ⅱ卷 非选择题
三、填空题(本题包括三个小题,共18分。)
21.(3分)(1)![]() (1分)
(1分)
(2)![]() (2分)
(2分)![]() (1分)
(1分)
22.(6分)正确;NH4Cl(AgNO3、NH4NO3);CH3COOH和CH3COONa(只答一种可能),
正确;CH3COONa;NH3·H2O和NH4Cl
不正确;因[H+]+[A+]>[B-]+[OH-] (每空2分)
23.(9分) (1)第四周期、第Ⅷ族 (2)FeCl2 Al2O3 (每格1分)
(3)8Al+3Fe3O4![]() 4Al2O3+9Fe (2分)
4Al2O3+9Fe (2分)
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑ (2分)
4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
(4) ①② (1分)
四、实验题(共10分)
24.(1) 0.15 (2分)(2)不变 (1分)(3) C (2分)
(4) 是__(2分)(5) ①0.01 ②10x+y-14 、 > (各1分)
五、计算题(共12分)
25、(共6分) 解:依题铝热剂中有Al和铁的氧化物
2Al+3H2SO4===Al2(SO4)3+3H2↑
2x27g 3x22.4L
X 11.2L X=9g
n(Al)=9g/27g.mol-1=1/3 mol (2分)
Fe+H2SO4===FeSO4+H2↑
56g 22.4L
Y 8.4L Y=21g
n(Fe)=21g/56g.mol-1=3/8 mol (2分)
2Al----Al2O3------3O
2 3
1/3 1/2 n(Fe):n(O)=3/8 :1/2=3:4 为Fe3O4
故铝热剂组成为Al和Fe3O4,分别为1/3mol和1/8mol. (2分)
26.(共6分) 解: 设n(Fe2O3)=x
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
x 3x x
Fe+Fe2(SO4)3=3FeSO4
x x
![]()
|
Fe + H2SO4 =FeSO4+ H2↑
1 1 1 1
0.15mol 0.15mol 0.15mol (2分)
则(x+0.15mol)×56g/mol+x×160g/mol+2.8g=22g
x=0.05mol
∴n(Fe)=0.05mol+0.15mol+![]() =0.25mol
=0.25mol
n(Fe2O3)=0.05mol n(Fe): n(Fe2O3)=0.25:0.05=5:1 (2分)
n(H2SO4)=3x0.15mol+0.15mol=0.6mol
c(H2SO4)=0.6mol/0.2L=3mol/L (2分)