化学平衡·综合测试题
一、选择题(本题包括21个小题,每小题有1~2个正确选项)
1.下列各组实验中反应速率最快的是
[ ]
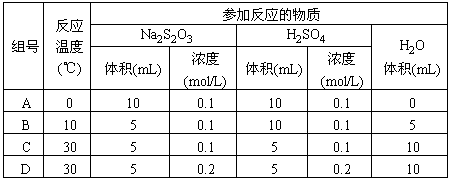
2.一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳.对此反应,下列叙述中正确的是
[ ]
A.使用催化剂不能改变反应速率
B.使用催化剂能增大反应速率或减小反应速率
C.降低压强能增大反应速率
D.升高温度能增大反应速率
3.下列反应加压后,对化学反应速率无影响的是
[ ]
A.N2+O2![]() 2NO
2NO
B.2SO2+O2![]() 2SO3
2SO3
C.CO+H2O(g)![]() CO2+H2
CO2+H2
D.H2SO4+2NaOH=Na2SO4+2H2O
4.反应aA(g)+bB(g)![]() cC(g)若vA = c mol/(L·s)则vC为
cC(g)若vA = c mol/(L·s)则vC为
[ ]
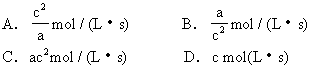
5.在2A(g)+B(g)![]() 4C(g)+D(s)-Q已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施
4C(g)+D(s)-Q已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施
[ ]
A.增大压强 B.增大C的浓度
C.使用催化剂 D.升高温度
6.已知工业上真空炼铷的反应方程式为2RbCl+Mg![]() MgCl2+2Rb(g),对于此反应能够进行正确解释的是
MgCl2+2Rb(g),对于此反应能够进行正确解释的是
[ ]
A.Rb比Mg金属性强
B.MgCl2对热稳定性差
C.高温下Mg2+得电子能力比Rb+弱
D.铷的沸点低,当把铷蒸气抽走时,平衡向正反应方向移动
7.在N2+3H2![]() 2NH3+Q的反应中,为提高NH3的产率,在下列措施中能采取
2NH3+Q的反应中,为提高NH3的产率,在下列措施中能采取
[ ]
A.使用催化剂 B.升温
C.加压 D.延长反应时间
8.对可逆反应A(g)+nB![]() 2C(g),恒温下,其反应物B的转化率(αB%)与压强的关系如图,则下列叙述中正确的是
2C(g),恒温下,其反应物B的转化率(αB%)与压强的关系如图,则下列叙述中正确的是
[ ]
A.B为固体n>1 B.B为液体n>1
C.B为气体n>1 D.B为气体n<1
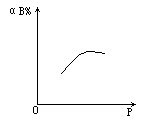
9.在200℃,1.01×105Pa条件下,H2+I2![]() 2HI+Q反应达到平衡时,再改变温度到300℃时,H2的物质的量是
2HI+Q反应达到平衡时,再改变温度到300℃时,H2的物质的量是
[ ]
A.不变 B.增大
C.减少 D.无法确定
10.在一化学平衡mA(g)+nB(g)![]() pC(g)+qD(g)A的转化率(αA%)同压强(Pa)、温度(T)的关系如图,分析下图可以得出的正确结论是
pC(g)+qD(g)A的转化率(αA%)同压强(Pa)、温度(T)的关系如图,分析下图可以得出的正确结论是
[ ]
A.正反应是吸热反应m+n>p+q
B.正反应是吸热反应m+n<p+q
C.正反应是放热反应m+n>p+q
D.正反应是放热反应m+n<p+q
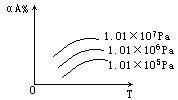
11.在温度相同,压强分别为p1、p2条件下,A(g)+2B(g)![]() nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.
nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.
下列结论正确的是
[ ]
A.p1>p2 n<3 B.p1<p2 n>3
C.p1<p2 n=3 D.p1>p2 n>3
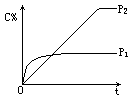
12.在2SO2+O2![]() 2SO3可逆反应中,为了充分利用SO2,可采用的方法是
2SO3可逆反应中,为了充分利用SO2,可采用的方法是
[ ]
A.增大压强 B.使用催化剂
C.增加氧气的浓度 D.增大SO2的浓度
13.2HI(g)![]() H2(g)+I2(g),在密闭容器中,装入1mol HI,在一定温度下,有50%发生分解,这时容器内气体的总物质的量是
H2(g)+I2(g),在密闭容器中,装入1mol HI,在一定温度下,有50%发生分解,这时容器内气体的总物质的量是
[ ]
A.0.5mol B.1.5mol
C.1mol D.2mol
14.在温度和压强不变时,1 L NO2分解,按2NO2![]() 2NO+O2反应达到平衡状态,若NO2的转化率为40%,则平衡时体积变为
2NO+O2反应达到平衡状态,若NO2的转化率为40%,则平衡时体积变为
[ ]
A.2.4L B.2.0L
C.1.2L D.1.0L
15.某温度下,反应N2O4(g)![]() 2NO2(g)-Q在密闭容器中达到平衡,下列说法中不正确的是
2NO2(g)-Q在密闭容器中达到平衡,下列说法中不正确的是
[ ]
A.体积变小时,将使正反应速率增大
B.体积保持不变,加入少许NO2,将使正反应速率减小
C.体积保持不变,加入少许N2O4,再达到平衡颜色变深
D.体积保持不变,升高温度,再达到平衡颜色变深
16.酶是蛋白质,因而具有蛋白质的特性.酶能催化多种化学反应,下列表示温度T与速率v关系的曲线(在下页),有酶参加的是
[ ]
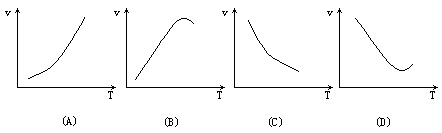
17.某温度下,反应A+B![]() 2C在密闭容器中进行,当反应达到平衡时,下列叙述中正确的是
2C在密闭容器中进行,当反应达到平衡时,下列叙述中正确的是
[ ]
A.当升高温度时,平衡逆向移动,说明正反应是放热的
B.升高温度时可增大正、逆反应速率、对平衡移动没有影响
C.若增加或减少B物质的量时,对化学平衡无影响,则B所处状态为气态
D.若A为气态,而加压平衡不移动,则B一定是气态,C也是气态
18.下列叙述中,正确的是
[ ]
A.在某一特定的可逆反应中,只要其它条件不变,不论是否使用催化剂,平衡时产物的浓度总是一定的
B.SO2氧化成SO3是放热反应,升高温度,逆反应速率增加,正反应速率减少,平衡向左移动
C.对气体反应来说增加压强不一定会使化学平衡发生移动
D.如果1 mol N2和3 mol H2在一定条件下,在密闭容器中反应,达到平衡时其必然生成2 mol NH3
19.在可逆反应x+2y![]() 2z-Q中,x、y、z是三种气体,为了有利于z的生成应采用的反应条件
2z-Q中,x、y、z是三种气体,为了有利于z的生成应采用的反应条件
(1)高温 (2)高压 (3)低温 (4)低压 (5)除去z (6)使用催化剂
[ ]
A.(1) (2) (6) B.(1) (2) (5)
C.(4) (5) (6) D.(2) (3) (5)
20.在密闭容器中进行下述反应:
aA+bB![]() cC+dD当反应达到平衡时物质C的浓度为[C]1,然后向容器中加入一定量的C,待反应再一次达到平衡时,C的浓度为[C]2.[C]1和[C]2的关系是
cC+dD当反应达到平衡时物质C的浓度为[C]1,然后向容器中加入一定量的C,待反应再一次达到平衡时,C的浓度为[C]2.[C]1和[C]2的关系是
[ ]
A.[C]1<[C]2
B.[C]1>[C]2
C.[C]1=[C]2
D.不一定,要视反应中方程式的系数而定
21.取1 mol A和a mol B按A(g)+aB(g)![]() bC(g)进行反应,当A
bC(g)进行反应,当A
![]()
则a、b可能是
[ ]
A.a=1,b=1 B.a=3,b=3
C.a=2,b=3 D.a=3,b=2
二、填空、简答、计算
1.在N2+3H2![]() 2NH3反应中,经2s后,NH3浓度增加0.6mol/L,则在此2s内,用H2浓度变化表示的平均反应速率为________
2NH3反应中,经2s后,NH3浓度增加0.6mol/L,则在此2s内,用H2浓度变化表示的平均反应速率为________
2.氨水中的平衡关系,用方程式表示为________
在平衡状态下,(1)增大压强,平衡________,则溶液的碱性________.(2)加入几滴强碱,平衡________.则溶液中________离子减少.(3)加入同浓度的氨水,平衡________.氨水的浓度________,碱性________.
3.在一定条件下,将A2和B2两种气体,通入2L密闭容器中,反应按下式进行:
![]()
mol/(L·s),vC=1mol/(L·s),则x的值为________,y的值为________.
4.在一密闭容器内,盛有HI气体,在400℃时建立如下平衡:2HI![]() H2+I2-Q如果降低温度、混合气体物质的量________,颜色________.
H2+I2-Q如果降低温度、混合气体物质的量________,颜色________.
*5.在一个容积不变的反应容器中,可以通过调节温度使下列反应A(g)+2B(g)![]() 2C(g)达到平衡时保持容器内气体总物质的量为15mol.现向反应容器中加6.5molA、XmolB、4molC.
2C(g)达到平衡时保持容器内气体总物质的量为15mol.现向反应容器中加6.5molA、XmolB、4molC.
(1)若X=5.5时需要降低体系温度才能使反应达平衡时符合题设条件,则正反应为________热反应.
(2)欲使该反应起始时维持逆向移动,则X的取值范围________.
(3)今有一定温度压强下的另一反应D(g)+E(g)![]() 2F(g),当按1∶2的物质的量之比充入D、E两种气体后达平衡时,D在平衡混合气体中的体积为P%.今向容器中投入m mol D和n mol F及一定量E,达平衡后测得D的体积分数仍为P%,则所投入的E为________mol.
2F(g),当按1∶2的物质的量之比充入D、E两种气体后达平衡时,D在平衡混合气体中的体积为P%.今向容器中投入m mol D和n mol F及一定量E,达平衡后测得D的体积分数仍为P%,则所投入的E为________mol.
*6.将4.6gN2O4晶体放入容积为4L的密闭容器里加热到298K,这时N2O4全部气化并发生反应:N2O4(g)![]() 2NO2(g),ΔH>0.在反应达到平衡时,(298K)测得混合气体的压强为同温度下N2O4气体尚未分解时压强的1.5倍.求:
2NO2(g),ΔH>0.在反应达到平衡时,(298K)测得混合气体的压强为同温度下N2O4气体尚未分解时压强的1.5倍.求:
(1)平衡时容器内混合气体的总物质的量及压强各是多少?
(2)平衡时容器内NO2与N2O4的物质的量之比是多少?
*7.有反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在一定条件下达到平衡.
4NO(g)+6H2O(g)在一定条件下达到平衡.
(1)如果上述反应在定容的密闭容器中进行,随反应由开始至平衡,混合气体对同条件下氢气的密度将做何变化?
(2)如果上述反应(定容定温)达到平衡后再向容器中压入一定体积的氩气,平衡将有何变化?
(3)如果上述反应于定温时在定压容器中达到平衡后,再充入氩气,平衡将有何变化?
*8.已知在800K时,FeO分解的K=3.5×10-14,H2O(g)分解的K=5.1×10-14.试比较在高温下和较低温度下,上述物质分解的难易程度.
*9.在1000K恒温下,在密闭容器中发生反应:
A(g)+3B(g)![]() 2C(g)
2C(g)
并达到平衡.测得其平衡时的浓度分别为:[A]=2mol/L,[B]=5mol/L,[C]=3mol/L,求:
(1)起始时A、B的物质的量浓度.
(2)同温下将压强增大一倍,通过平衡常数的计算,说明平衡移动的方向.
三、计算题
1.在一定温度、压强和有催化剂存在时将N2和H2以体积比为1∶3混合,反应达到平衡时,混合气体中NH3占25%(体积分数).如果混合前N2为100mol.试计算有多少mol N2转化为NH3?
2.在373K时把0.5mol N2O4气体通入5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2浓度为0.02mol/L.在60s时,体系达到平衡,此时容器内压强是开始时的1.6倍.求:
(1)在2s时体系的压强为开始的多少倍?
(2)在平衡体系内N2O4的物质的量.
参考答案
一、1.D 2.B、D 3.D 4.A 5.D 6.D 7.C 8.C 9.B 10.A 11.D 12.A、C 13.C 14.C 15.B 16.B 17.A、D 18.A、C 19.B 20.A 21.A、D
二、1.0.45mol·L-1·s-1
2.NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
(1)正向移动,增强 (2)逆向移动,NH4+
(3)不移动,不变,不变
3.x=1,y=3
4.不变,变浅
5.(1)放热(此时n总=16mol,反应需朝体积减小的正方向进行才能维持容器内n总=15mol)
![]()
为维持逆向进行要求:
①6.5+x1+4<15,x<4.5
②6.5+2+x2+4=15 x=2.5
∴2.5<x<4.5
(3)2m+n/2
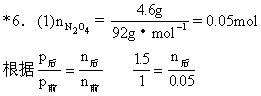
n后=0.075mol.
由PV=nRT
![]()
(2)设分解的N2O4为x
由 N2O4![]() 2NO2
2NO2
得 0.05-x+2x=0.075
x=0.025

*7.(1)减小 (2)不移动 (3)向正反应方向移动
*8.温度越高,分解越容易;温度越低,分解越难.而且水的分解比FeO的分解难易程度的变化更显著

则[A]起=2mol·L-1+1.5mol·L-1=3.5mol·L-1
[B]起=5mol·L-1+4.5mol·L-1=9.5mol·L-1
(2)压强增大一倍,即浓度增大一倍
即[A]=4mol·L-1 [B]=10mol·L-1 [C]=6mol·L-1
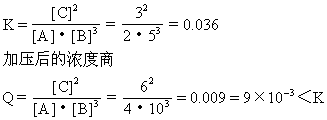
因此反应向正方向移动.
三、1.由气体状态方程得出平衡时NH3占混合气体的摩尔分数也是25%


所以有40 mol N2转化为NH3.
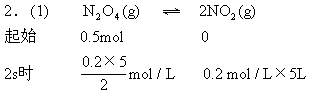
由气体状态方程有
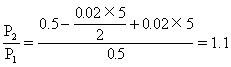
即2s时体系的压强为开始的1.1倍
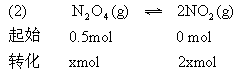
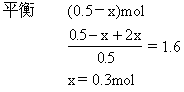
平衡时N2O4的物质的量为0.5-0.3=0.2mol
|
|