化学反应速率、化学平衡练习
( )[1].在下列过程中,需要加快化学反应速率的是
A 塑料老化 B 合成氨 C 钢铁腐蚀 D 食物腐败
( )[2].在2CH4(g)+2NH3(g)+3O2(g)![]() 2HCN(g)+6H2O(g)反应中,已知v(HCN)=n mol/(L·min),且v(O2)=m mol/(L·min)。则m与n的关系正确的是
2HCN(g)+6H2O(g)反应中,已知v(HCN)=n mol/(L·min),且v(O2)=m mol/(L·min)。则m与n的关系正确的是
A m=n/2 B m=2n/3 C m=3n/2 D m=2n
( )[3].将4mol
A气体和2mol
B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若是2min后测得C的浓度为0.6mol/L,现有下列说法,正确的是
2C(g)。若是2min后测得C的浓度为0.6mol/L,现有下列说法,正确的是
A 物质A表示的反应速率为0.3mol/(L·min)
B 物质B表示的反应速率为0.6mol/(L· min)
C 2min时物质A的转化率为70%
D 2min时物质B的浓度是0.7mol/L
( )[4].一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳。对此反应,下列叙述中正确的是
A 使用催化剂不能改变反应速率 B 使用催化剂能改变反应速率
C 改变压强对反应速率没有影响 D 降低压强能加大反应速率
( )[5].某温度下,反应2N2O5=4NO2+O2开始进行时,c(N2O5)=0.0408mol/L。经1min后,c(N2O5)=0.030mol/L。则该反应的反应速率是
A v(N2O5)=1.8×10-4mol·L-1·s-1 B v(N2O5)=1.8×10-2mol·L-1·s-1
C v(NO2)=1.8×10-4mol·L-1·s-1 D v(O2)=1.8×10-4mol·L-1·s-1
(
)[6].已知:4NH3+5O2=4NO+6H2O,若反应速率分别用![]() 、
、![]() 、
、![]() 、
、![]() (mol/L·min)表示,则正确的关系是
(mol/L·min)表示,则正确的关系是
A ![]()
![]() =
=![]() B
B ![]()
![]() =
=![]() C
C ![]()
![]() =
=![]() D
D ![]()
![]() =
=![]()
( )[7].在2A+B![]() 3C+4D反应中,表示该反应速度最快的是
3C+4D反应中,表示该反应速度最快的是
A vA=0.5mol/(L·s) B vB=0.5mol/(L·s)
C vC=0.8mol/(L·s) D vD=1mol/(L·s)
( )[8].反应2SO2+O2![]() 2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为
2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为
A 0.1s B 2.5s C 5s D 10s
( )[9].在2L的密闭容器中,发生以下反应:2A(气)+B(气)![]() 2C(气)+D(气)若最初加入的A和B都是4 mol,在前10s A的平均反应速度为0.12 mol/(L·s),则10s时,容器中B的物质的量是
2C(气)+D(气)若最初加入的A和B都是4 mol,在前10s A的平均反应速度为0.12 mol/(L·s),则10s时,容器中B的物质的量是
A 3.6 mol B 2.8 mol C 2.4 mol D 1.2 mol
( )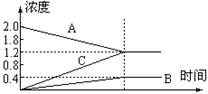 [10].右图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,T是平衡的时间,能以此曲线表示的反应是
[10].右图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,T是平衡的时间,能以此曲线表示的反应是
A 2A![]() B+3C B B+3C
B+3C B B+3C![]() 2A
2A
C A+C![]() B D B
B D B![]() A+C
A+C
( )[11].等质量的SO2和O2混合,在一定条件下反应,当达到平衡时,SO2与O2的转化率,前者与后者关系是
A 大于 B 小于 C 等于 D 不能肯定
( )[12].一定温度下,可逆反应A2(g)+B2(g)![]() 2AB(g)达到平衡状态的标志是
2AB(g)达到平衡状态的标志是
A 单位时间内生成 n mol A2,同时生成 n mol AB
B 体系内的总压不随时间变化
C 单位时间内生成2n mol AB的同时生成n mol B2
D 单位时间内生成 n mol A2的同时,生成n mol B2
( )[13].在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
A(S)+3B(g)![]() 2C(g)+D(g) 已达平衡状态的是
2C(g)+D(g) 已达平衡状态的是
A 混合气体的压强不随时间变化
B B的生成速率和D的反应反应速率为3︰1
C 混合气体的密度不随时间变化
D B、C、D的分子数之比为3︰2︰1
( )[14].对已达化学平衡的下列反应:2X(g)+Y(g)![]() 2Z(g)减小压强时,对反应产生的影响是
2Z(g)减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
( )[15].在一密闭烧瓶中,在25℃时存在着平衡:2NO2![]() N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
A ①和③ B ②和④ C ④和⑤ D ③和⑤
( )[16].对于mA(g)+nB(g)![]() pC(g)+qD(g)的平衡体系,当升高温度时,体系的平均分子量对氢气的相对密度从16.5变成16.9,则下列说法正确的是
pC(g)+qD(g)的平衡体系,当升高温度时,体系的平均分子量对氢气的相对密度从16.5变成16.9,则下列说法正确的是
A m+n>p+q 正反应是放热反应 B m+n>p+q 正反应是吸热反应
C m+n<p+q 逆反应是放热反应 D m+n<p+q 逆反应是吸热反应
17. 2A ![]() B + C在某一温度时,达到平衡。
B + C在某一温度时,达到平衡。
(1) 若温度升高,平衡向正反应方向移动,则正反应是___________反应(填放热或吸热);
(2) 若B为固体,降低压强平衡向逆反应方向移动,则A呈___________态;
(3) 若A是气态时,加压时,平衡不移动,则B为_________态,C为__________态;
(4) 若A、B、C均为气体,加入催化剂,平衡___________移动(填正向、逆向、不)。
18. 在6L的密闭容器中,将2 mol N2和8 mol H2按下式进行可逆反应:N2 +3H2
![]() 2NH3,在某一温度下,5min后达到化学平衡状态,若测得平衡混合气体的压强是原混合气体压强的0.8倍。求:(1)5 min内H2的平均反应速率 ; (2)N2的转化率?
2NH3,在某一温度下,5min后达到化学平衡状态,若测得平衡混合气体的压强是原混合气体压强的0.8倍。求:(1)5 min内H2的平均反应速率 ; (2)N2的转化率?
[1] B
[2] C
[3] A、D
[4] B
[5] A
[6] D
[7] B
[8] C
[9] B
[10] A
[11] A
[12] C
[13] C
[14] C
[15] D
[16] B、D
17.(1)吸热(2)气(3)气、气(4)不
18.0.1 mol/(L·min) 50%