高二化学第三章测试题
时间:60分钟 总分:110分 命题人:邹桂英
可能用到的相对原子质量:H-1 O-16 C-12 N-14 K-39 P-31 Na-23 S-32
一.选择题(每小题只有一个选项符合题意)
1.都不能用磨口玻璃瓶存放的一组是
A.溴水、氨水、氯水 B.AgNO3、KMnO4、MnO2
C.浓H2SO4、浓HNO3,浓盐酸 D.NaOH、Na2CO3、水玻璃
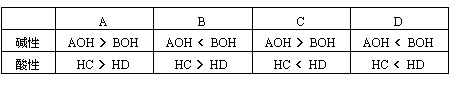 2.用一价离子组成的四种盐:AC、BD、AD、BC的1mol/L溶液,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7,则
2.用一价离子组成的四种盐:AC、BD、AD、BC的1mol/L溶液,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7,则
3. 已知常温下、常压下,饱和![]() 溶液的pH为3.9。则可推断用已知浓度的盐酸滴定未知浓度的
溶液的pH为3.9。则可推断用已知浓度的盐酸滴定未知浓度的![]() 溶液时,应选用的指示剂及滴定终点的颜色变化是
溶液时,应选用的指示剂及滴定终点的颜色变化是
A.石蕊,由蓝变红 B.酚酞,红色褪去 C.甲基橙,由橙变黄 D.甲基橙,由黄变橙
4.下列说法不正确的是
A.强酸强碱所生成盐的水溶液呈中性 B.强酸弱碱所生成盐的水溶液呈酸性
C.强碱弱酸所生成盐的水溶液呈碱性 D.酸式盐的水溶液一定呈酸性
5. 为了除去氯化锌酸性溶液中的Fe3+离子可在加热和搅拌的条件下,加入一种试剂,使溶液的pH升高,过滤后再加入盐酸,这种试剂可以是
A.Na2CO3
B.Zn(NO3)2
C.KOH D.ZnCO3
6.某溶液中,由水电离出来的c(OH-)=1×10-9mol/L,则此溶液不可能是
A.pH=5的强酸或弱酸溶液
B. pH=9的K2CO3溶液
C.pH=5的NaHSO4溶液 D. pH=9的强碱或弱碱溶液
7.在pH=1的溶液中,可以大量共存的离子组是
A.K+、Na+、S2-、Cl- B.Al3+、Mg2+、SO42-、Cl-
C.Mg2+、K+、AlO2-、NO3- D.Zn2+、Na+、S2O32-、SO42-
8.在下列溶液中:①pH=14的 NaOH溶液②0.5mol/L NaOH溶液③0.1mol/L Na2CO3 溶液④0.1mol/LKHCO3溶液⑤0.1mol/L (NH4)2CO3⑥0.1 mol/L HNO3溶液,由水电离的[H+]由大到小的顺序为
A.⑥⑤④③②① B.①②⑥③④⑤ C.⑤③④⑥②① D.⑤③④⑥①②
9. 用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而减小的是
A c(OH-)/c(NH3·H2O) B c(NH3·H2O)/c(OH-)
C c(H+)和c(OH-)的乘积 D OH-的物质的量
10.分别在pH=1的酸和pH=14的NaOH溶液中加入足量的Al,放出H2的量前者多。其原因可能是
A.两溶液体积相同,酸是多元强酸 B.两溶液体积相同,酸是一元弱酸
C.酸溶液体积小于NaOH溶液的体积 D.酸是强酸,浓度比NaOH溶液的大
11.CH3COOH溶液与NaOH溶液反应,若反应后溶液的pH为7,那么
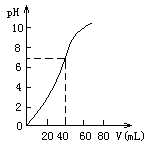 A.CH3COOH与NaOH的质量相等
B. NaOH过量
A.CH3COOH与NaOH的质量相等
B. NaOH过量
C. CH3COOH与NaOH的物质的量相等 D. CH3COOH过量
12. 用1.0mol/LNaOH溶液中和某未知浓度的硫酸溶液,其中和
过程中溶液pH值和所用NaOH溶液体积关系如右图所示。则原
H2SO4溶液的物质的量浓度和完全中和后溶液的大致体积是
A.1.0mol/L,60Ml B.0.5mol/L,80mL
C.0.5mol/L,40mL D.1.0mol/L,80mL
13. 对某雨水的水样分析数据如下:除含有H+和少量OH-外还有:c(Ca2+)=3.6×10-6mol·L-1,c(NH4+)=2.0×10-6mol·L-1, c(Cl-)=3.5×10-6mol·L-1,c(NO3-)=4.5×10-6mol·L-1,c(SO42-)=5.0×10-6mol·L-1,则此雨水的pH值约为
A.3 B.4 C.5 D.6
二、选择题(每小题有1-2个选项符合题意)
14. 下列离子方程式正确的是
A.硫酸铵溶液中滴入氢氧化钡溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O
B.石灰石与醋酸混合:CaCO3+2H+=Ca2++CO2↑+H2O
C.铜片溶于硝酸:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
D.钠与水反应:Na+2H2O=Na++2OH-+H2↑
 15.下列微粒能破坏水的电离平衡的是
15.下列微粒能破坏水的电离平衡的是
C.Al3+ D.Ba2+
16.某无色溶液中加入过量盐酸有沉淀产生,过滤后向滤液中加入过量的纯碱溶液又有沉淀产生,下列溶液中符合此条件的是
①Ag+、Fe3+、Na+②Ag+、Al3+、K+③Ag+、Ba2+④SiO32-、AlO2-、K+⑤Ag+、NH4+、H+⑥SiO32-、K+、Al3+
A 各组均符合 B ②③④ C②③ D ①②③④
17. 室温下浓度为0.1mol/L的HA,HB,HC,HD 4种一元酸,其中HA溶液中[H+]=0.01mol/L,HB的电离度为0.1%,HC的pH为3,HD溶液中[OH-]=10-13mol/L。4种酸对应的钠盐,在物质的量浓度相等的条件下,其溶液的pH值从大到小的顺序为
A.NaA>NaB>NaC>NaD B.NaB>NaC>NaA>NaD
C.NaD>NaA>NaC>NaB D.NaC>NaB>NaD>NaA
18. 在0.1mol/L的硫化钠溶液中,下列关系正确的是
![]() A.0.1=[S2-]+[HS-]+[H2S]
B.[OH-]=[H+]+[HS-]+2[H2S]
A.0.1=[S2-]+[HS-]+[H2S]
B.[OH-]=[H+]+[HS-]+2[H2S]
D.[Na+]>[S2-]>[H+]>[HS-]>[OH-]
高二化学第三章测试题答题卡
姓名: 学号: 分数:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
| 题号 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、填空题
19.(每空2分共8分)现有下列溶液:①20mL0.1mol·L-1H2SO4溶液②40mL0.1mol·L-1CH3COOH溶液③40mL0.1mol·L-1HCl溶液④40mL0.1mol·L-1NaOH溶液⑤20mL0.1mol·L-1Ba(OH)2溶液。其中:(1)c(H+)最小的是
(2)任取2份溶液混合,混合后溶液的pH为7(或接近7),有 种取法。
(3)②和④混合后,溶液的pH 7(填>、<、=)
(4)混合后出现白色沉淀的两种溶液是:
20.(每空3分共18分)重铬酸钾(K2Cr2O7)是橙色晶体,铬酸钾(K2CrO4)是黄色晶体,将重铬酸钾溶于水,配成2%的溶液,重铬酸钾发生水解,反应的离子方程式如下:Cr2O72-+H2O
![]() 2CrO42-+2H+,当达平衡时,溶液的颜色介于橙色和黄色之间。
2CrO42-+2H+,当达平衡时,溶液的颜色介于橙色和黄色之间。
(1)将10滴2mol/LNaOH溶液滴入3 mL2%的颜色介于橙色和黄色之间的K2Cr2O7溶液中,现象___ ___,理由____ __。
(2)将5滴2mol/LH2SO4溶液加入上述(1)所得溶液中,现象____ __,理由是___ __。
(3)在上述(2)所得溶液中,再滴入5滴2mol/LH2SO4溶液,现象__ _,理由是____ __。
21.(20分)已知NH4+和HCHO在水溶液中有如下反应:4NH4++6HCHO=(CH2)6N4+4H++6H2O
已知生成的HCHO和(CH2)6N4不与盐酸和NaOH溶液反应。有一失去标签的铵盐,为了测定其含氮量做如下实验,就此实验完成以下填空:
A.用移液管移取出10.0mL铵盐和HCHO的混合液,滴入酚酞试剂。
B把锥形瓶放在滴定管的下面,用标准NaOH溶液滴至终点,并记下滴定管液面的刻度。
C.称取2.0g样品溶于水,加入足量的HCHO溶液,配成100mL溶液。
D.用标准溶液润洗滴定管2次—3次,取标准NaOH溶液注入 (填“酸式”或“碱式”,该空2分)滴定管至刻度0以上2cm—3cm,调节滴定管尖嘴,使之充满溶液。
E.调节液面至0或0以下刻度,记下读数。
(1)正确操作步骤的顺序是(用序号字母填写)____
______________。
(2)上述(B)步骤操作之前,先用待测溶液润洗锥形瓶,则对测定含氮量结果的影响是___________。(填“偏高”、“偏低”或“不影响”)
(3)C实验中不需要的仪器有___ ____(填序号),还缺少的仪器有__ __(填名称)。
a. 托盘天平(带砝码、镊子);b. 滴定管;c. 100mL量筒;d.
100mL容量瓶;e. 烧杯;f. 漏斗;g. 锥形瓶;h. 玻璃棒;i. 药匙;j. 烧瓶。
(4)判断到达滴定终点的实验现象是_________________________
(5)当消耗0.10mol/L的NaOH溶液25.00mL时,该铵盐中N的质量分数为:
四、计算题(10分)
22. 已知百里酚酞的变色范围是9.4~10.2。相同物质的量浓度的三种稀溶液:NaH2PO4 pH=4.7、Na2HPO4 pH=10、Na3PO4 pH=12。今有0.5g某种磷酸钠盐水合物溶于50mL0.1mol/L的H2SO4溶液中,稀释至100mL。取出1/5该溶液(以百里酚酞作指示剂)需0.1mol/L的NaOH溶液26.4mL中和,试求:
(1)滴定终点时生成的钠盐是什么。
(2)求原磷酸钠盐水合物的化学式。
每小题3分,第二大题,如有两个答案,只选了一个且正确,给2分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | A | D | D | D | B | B | C | B | B | D | B | C |
| 题号 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | BC | B | B | AB |
19.(每空2分)(1)⑤ (2)4 (3)> (4)①⑤
20.(每空3分)(1)溶液变黄色 OH-与H+反应,减少H+浓度,平衡向右
(2)介于橙色与黄色之间, H+恰好中和(1)中的OH-
(3)橙色 c(H+)变大平衡向左移动
21.碱式(该空2分,其余每空3分),(1)CADEF (2)偏高 (3)bfgj 胶头滴管
(4)滴加最后一滴时,溶液颜色变浅红色,且半分钟不消失 (5) 17.5%
22.(1)Na2HPO4 (2分) (2) NaH2PO4·2H2O(要有计算过程,8分)
每小题3分,第二大题,如有两个答案,只选了一个且正确,给2分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | A | D | D | D | B | B | C | B | B | D | B | C |
| 题号 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | BC | B | B | AB |
19.(每空2分)(1)⑤ (2)4 (3)> (4)①⑤
20.(每空3分)(1)溶液变黄色 OH-与H+反应,减少H+浓度,平衡向右
(2)介于橙色与黄色之间, H+恰好中和(1)中的OH-
(3)橙色 c(H+)变大平衡向左移动
21.碱式(该空2分,其余每空3分),(1)CADEF (2)偏高 (3)bfgj 胶头滴管
(4)滴加最后一滴时,溶液颜色变浅红色,且半分钟不消失 (5) 17.5%
22.(1)Na2HPO4 (2分) (2) NaH2PO4·2H2O(要有计算过程,8分)
每小题3分,第二大题,如有两个答案,只选了一个且正确,给2分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | A | D | D | D | B | B | C | B | B | D | B | C |
| 题号 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | BC | B | B | AB |
19.(每空2分)(1)⑤ (2)4 (3)> (4)①⑤
20.(每空3分)(1)溶液变黄色 OH-与H+反应,减少H+浓度,平衡向右
(2)介于橙色与黄色之间, H+恰好中和(1)中的OH-
(3)橙色 c(H+)变大平衡向左移动
21.碱式(该空2分,其余每空3分),(1)CADEF (2)偏高 (3)bfgj 胶头滴管
(4)滴加最后一滴时,溶液颜色变浅红色,且半分钟不消失 (5) 17.5%
22.(1)Na2HPO4 (2分) (2) NaH2PO4·2H2O(要有计算过程,8分)