江苏省泰兴中学高二化学期末测试题 2006.1
命题范围:(第二章化学平衡~第五章烃)
班级 姓名 学号
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 P:31 S:32 Cl:35.5 Fe:56 Cu:64 Ag:108
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分,每题只有一个正确选项,)
1.下列各组物质的分类正确的是
①混合物:氯水、氨水、汽油 ②电解质:硫酸钡、无水H2SO4、苛性钠
③非极性分子:CO2、CH2Cl2、对二甲苯 ④同素异形体:C60、金刚石、石墨
A.①③④ B.②③④ C. ①②④ D.全部
2.下列分子中成键原子不可能都处于同一平面上的是
A.乙烯 B.苯 C.苯乙烯 D.聚乙烯
3.下列反应生成物为纯净物的是
A.氯乙烯加聚 B.乙烯与氯化氢加成 C.乙醇与浓硫酸共热 D.甲烷与氯气光照
4.在滴加酚酞的0.01mol/L的氨水中加入一定量NH4Cl晶体,溶液的颜色
A. 变浅 B.变深 C. 变蓝色 D.不变
5.将PH试纸用蒸馏水湿润后,去测定某溶液的PH值,该溶液的PH值将会
A.偏高 B.偏低 C.不变 D.上述三种情况均有可能
6.下列取代基或粒子中,碳原子都满足最外层为8电子的是
A.甲基 (—CH3) B.碳正离子 (CH3)3C+
C.碳负离子( CH3-) D.碳烯(:CH2)
7.分别用铁a,氧化亚铁b,混有少量Fe2O3的铁c,制取相同质量的绿矾需要H2SO4的质量为
A. a=b>c B. a=b=c C. b>a>c D. c>b>a
8.钢铁发生吸氧腐蚀时,正极发生反应的电极反应式为
A.Fe-2e-=Fe2+ B. Fe-3e-=Fe3+ C.O2+2H2O+4e-=4OH- D.2H++2e-= H2 ↑
二、选择题(本题包括10小题,第10~16题每题4分,17~18题每题5分,共42分)
9.向硝酸钠溶液中加入铜粉不发生反应,若再加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是
![]() A.Fe(NO3)3 B.ZnSO4 C. NaHSO4 D. NaHCO3
A.Fe(NO3)3 B.ZnSO4 C. NaHSO4 D. NaHCO3
10.某温度下,在容积固定的密闭容器中,发生可逆反应中A(g)+2B(g) 2Q(g)
平衡时,各物质的浓度比为C(A):C(B):C(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A.B.Q,则下列叙述正确的是
A.刚充入时反应速率V(正)减小,V(逆)增大
B.达到新的平衡时,反应混合物中A.B的体积分数增加
C. 达到新的平衡时, C(A):C(B):C(Q)仍为1:1:2
D. 达到新的平衡过程中,体系压强先增大,后减小
11.NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共价键数目为6NA
C.标准状况下,铝和NaOH溶液反应生成11.2L气体时,电子转移数为NA
D.1L1mol/L的AlCl3溶液中的Al3+的个数为NA
12.下列各组离子⑴I-、ClO-、NO3-、Cl- ⑵K+、NH4+、HCO3-、OH- ⑶SO32-、SO42-、Cl-、OH- ⑷Fe2+、Cu2+、SO42-、Cl- ⑸Fe3+、SCN-、K+、SO42- ⑹H+、K+、AlO2-、HSO3- 在溶液中能大量共存的组别共有
A.1组 B.2组 C.3组 D.不少于4组
![]() 13.某有机物链状分子中含n个-CH2-,m个 -CH-,a个-CH3,其余为氯原子。则氯原子的个数为
13.某有机物链状分子中含n个-CH2-,m个 -CH-,a个-CH3,其余为氯原子。则氯原子的个数为
A.2n+3m-a B.m+2-a C.n+m+a D.m+2n+2-a
14.下列有关叙述正确的是
A. 纯铁比生铁耐腐蚀
B.甲苯和溴水混合,在铁作催化剂时能发生苯环上的取代反应
C.工业上用铝热反应冶炼铁
D. 使用正催化剂能加快反应速率,缩短到达平衡的时间,提高反应物的转化率
15.下列反应的离子方程式正确的是
A.将Cu粉加入FeCl3溶液中:Cu+Fe3+ =Cu2++Fe2+
B.将Al粉加入NaOH溶液中:Al+2OH-+H2O=AlO2-+2H2↑
C.FeI2溶液中通入少量Cl2:2I-+Cl2 =I2+2Cl-
D.往KAl(SO4)2溶液加入Ba(OH)2溶液至SO42-沉淀完全:
2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 2Al(OH)3↓+ 3BaSO4↓
16. ![]() 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn — 2e— + 2OH— = Zn(OH)2
B.放电时正极反应为:Fe(OH)3 — 3e— + 5OH— = FeO42— + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
17.向某FeBr2溶液中,通入不1.12L (标准状况下)的Cl2,测得溶液中C(Br-)=3C(Cl-)=0.3mol/L(反应过程中溶液的体积变化及离子的水解不计)则下列说法中正确的是
A.原溶液的浓度为0.1mol/L B.反应后溶液中C(Fe3+)=0.1mol/L
C.原溶液中C(Br-)=0.4mol/L D. 反应后溶液中C(Fe3+)=2C(Fe2+)
18.物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
A. C(HX)+C(X-)=C(Na+)=0.1mol/L B. C(Na+)+C(H+)=C(X-)+C(OH-)
C. 若溶液呈碱性,则C(Na+)> C(HX)> C(X-)>C(OH-)>C(H+)
D. 若溶液呈酸性,则C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-)
第Ⅱ卷(非选择题 共78分)
三、(本大题共两小题,共21分)
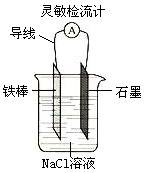 19.(1)下列有关实验的叙述正确的是(填序号)
19.(1)下列有关实验的叙述正确的是(填序号)
A.用酸式滴定管量取20.00mlKMnO4溶液
B. 蒸干并灼烧FeCl3溶液可得纯净的无水氯化铁;
C.用已知浓度的盐酸滴定未知浓度的氨水,选用酚酞用指示剂
D. 制Fe(OH)2时,盛NaOH溶液的滴管不能伸入到试管底部
E.为了使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用 铜丝网包裹的锌粒
F.如右图,可观察到灵敏检流计的指针偏转;
(2)有一瓶浅绿色的硫酸亚铁晶体,由于保存不善,又放置了较长时间,可能被氧化,试用实验证明它是部分被氧化,还是完全被氧化,并完成实验报告
实验目的:
实验步骤(1)取少量晶体溶于水,加稀硫酸酸化
(2)
(3)
结论:
20. 实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质。某同学设计了如下装置(气密性良好),通过使弹簧夹K1和K2打开或关闭控制气体流向,证明乙烯中混有CO2、SO2并验证乙烯的性质。
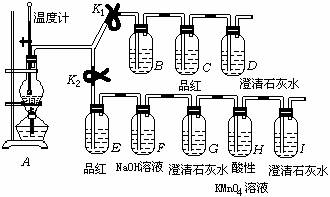
(1) 烧瓶中放入几块碎瓷片的作用是 ,图中一处明显错误是
(2) 若实验时看到G中澄清石灰水无明显现象但I中澄清石灰水混浊,请对出现该现象的原因提出一合理的猜想是:
(3) 说明混合气体中含有CO2的现象是 : 说明混合气体中含有乙烯的现象是:
(4) F中NaOH溶液的作用是:
B中应盛放的试剂是: (选填“溴水”或“酸性高锰酸钾溶液”)。
四、(本大题共两小题,共21分)
21. A~I分别表示中学化学中常见的一些物质,它们之间相互关系如下图所示(部分反应物,生成物没有列出),已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: 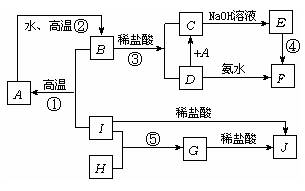
(1) A、B、C、D、E、F六种物质所含的同一种元素是:Fe;
(2) G、F的化学式分别是: 、
(3) 写出①②④反应的化学方程式:
①
②
④
(4) G与NaOH溶液反应的离子方程式:
(5) 在①②③④⑤反应中,属于放热反应的是:
22.t℃将3molA和2molB气体通入固定体积为2L的密闭容器中,发生如下反应
![]()
3A(g)+B(g) XC(g),2min时反应达平衡。(温度不变)剩余1.8molB,
并测得C的的浓度为0.4mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ,X= 。
(2).比较达到平衡时,A.B两反应物的转化率:![]()
![]() (填> = 或 < )
(填> = 或 < )
(3).若继续向原平衡混合物的容器中通入少量氩气(氩气和A.B.C均不反应)后,则平衡
(填“向左移动”“ 向右移动”“不移动”)
(4)在t℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入 (填A或B) mol(用a表示),达新平衡时,A的物质的量为n(A)= (用含a的式子表示)
五、(本大题共2小题,共19分)
23.烷烃分子中,与碳原子相结合的氢原子有3个,2个,2个等不同情况,分别用伯氢、仲氢、叔氢加以区别,如下式所示:![]() 。在烷烃的取代反应中,伯、仲、叔三种氢原子被取代的几率(机会)不同,但同类氢原子被取代的几率(机会)可视为相同。现将nmol 2—甲基丁烷与适量溴蒸气在一定条件下完全反应,若只生成四种一溴代物和溴化氢,则
。在烷烃的取代反应中,伯、仲、叔三种氢原子被取代的几率(机会)不同,但同类氢原子被取代的几率(机会)可视为相同。现将nmol 2—甲基丁烷与适量溴蒸气在一定条件下完全反应,若只生成四种一溴代物和溴化氢,则
(1)反应中生成溴化氢的物质的量为 mol。
(2)将反应生成的四种一溴代物的混合气体充分燃烧,生成H2O,CO2和HBr,此时需消耗氧气 mol
(3)若上述溴的取代反应中,伯、仲、叔氢原子被溴原子取代的几率比为a:b:c,则生成的四种一溴代物中,![]() 所占的物质的量分数为
。
所占的物质的量分数为
。
24..自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔(CH≡C-![]() )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
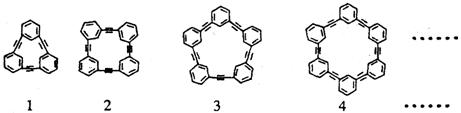
(1)上述系列中第2种物质的分子式为 。
(2)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为 。
(3)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(CH2=CH-![]() )为起始物质制得。请结合下列反应规律:CH3CH2Cl+NaOH
)为起始物质制得。请结合下列反应规律:CH3CH2Cl+NaOH![]() CH2=CH2↑+NaCl+H2O写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
CH2=CH2↑+NaCl+H2O写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
五.(本题包括2小题,共17分)
25.Cu和Fe2O3的混合物粉末22.4g加入到1mol/LH2SO4溶液中,充分反应后,
(1)若固体恰好全部溶解,消耗H2SO4的体积为VL,求V的取值范围
(2)若H2SO4溶液过量,反应后溶液体积为1L,测得此溶液中C(Fe2+)=0.1mol/L,求原混合物中含Cu多少克?
26.A、B、C为三种链烃,其碳原子数有如下组合:
| 组 别 | 碳原子数 | ||
| A | B | C | |
| ① | 3 | 3 | 6 |
| ② | 3 | 3 | 4 |
| ③ | 1 | 4 | 5 |
| ④ | 2 | 4 | 4 |
| ⑤ | 5 | 2 | 7 |
| ⑥ | 2 | 2 | 4 |
试回答下列问题:
(1)若B、C为烷烃,且在一定条件下C可分解(裂化)为A和B,则满足此条件的可能组别是(填组别序号) 。
(2)若组别⑥中A为烷烃,B为炔烃,C为烯烃,且A、B、C三种物质按物质的量1:1:2混合,取标准状况下该混合物和过量O2组成的混合气体840mL,电火花点燃,将燃烧后的产物用过量碱石灰吸收,碱石灰增重0.93g。求:碱石灰吸收后所剩气体在标准状况下的体积。
江苏省泰兴中学高二化学期末测试题参考答案
一、选择题(每小题4分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | D | B | A | D | C | B | C |
二.选择题
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AC | D | BC | B | B | A | C | BC | BD | BC |
选择题答案详解:
第1题: ③中CH2Cl2、对二甲苯为极性分子,故分类正确的是①②④,选C
第2题:选D
第3题:所有的高聚物均为混合物; 乙醇与浓硫酸共热时可生成多种产物如乙醚、乙烯、CO2、SO2等;甲烷与氯气光照可生成一氯代物、二氯代物直至六氯代物、HCl等;故选B
第4题: 氨水中存在NH3·H2O![]() NH4++OH-,当加入一定量NH4Cl晶体后,平衡左移,
NH4++OH-,当加入一定量NH4Cl晶体后,平衡左移,
C(OH-)减小,红色变浅,故选A
第5题: 将PH试纸用蒸馏水湿润后去测定某溶液的PH值,若原溶液为酸性,测得的PH偏大,若原溶液为碱性,,测得的PH偏小,若原溶液为中性,则测得的PH值无影响。故选D
第6题: —CH3 碳原子最外层为7个电子;(CH3)3C+中有有3个碳原子最外层为8电子结构,有一个碳原子为6电子结构;碳烯(:CH2) 最外层为6电子结构;只有碳负离子( CH3-)碳原子都满足最外层为8电子结构;故选C
第7题: 制取相同质量的绿矾,即制取相同物质的量的绿矾,根据硫元素物质的量守恒,则需硫酸的物质的量相等。故选B
第8题:选C
第9题: 向硝酸钠溶液中加入铜粉后,当再加入Fe3+时,2Fe3++ Cu = Fe2++Cu2+铜粉逐渐溶解;
当再加入NaHSO4时,发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O铜粉逐渐溶解;故选AC
第10题:容积固定的密闭容器中,发生可逆反应![]() 当再以1:1:2的体积比再充入A.B.Q时,相当于将密闭容器加压,平衡右移,又达新的平衡后,反应混合物中A.B的体积分数减小,C(A):C(B):C(Q)不再为1:1:2,当充入的瞬间体系压强增大,右移后压强减小。故选D
当再以1:1:2的体积比再充入A.B.Q时,相当于将密闭容器加压,平衡右移,又达新的平衡后,反应混合物中A.B的体积分数减小,C(A):C(B):C(Q)不再为1:1:2,当充入的瞬间体系压强增大,右移后压强减小。故选D
第11题: A错.标准状况下戊烷为液体;11.2L的戊烷物质的量不等于0.5mol;D错
由于AlCl3溶液中Al3+要水解,Al3+的个数小于NA;1mol乙烯中含6mol共价键,故28g乙烯所含共价键数目为6NA,铝和NaOH溶液反应时,铝失电子,水得电子成H2,当生成11.2L气体时,电子转移数为NA,故选BC。
第12题: ⑴中I-与ClO-发生氧化还原反应;⑵中NH4+与OH-→NH3·H2O HCO3-与OH-→CO32-+H2O;⑸中Fe3+与SCN-→Fe(SCN)3,⑹中H+与AlO2- →Al(OH)3 ,
AlO2-与HSO3-→Al(OH)3+ SO32-,所以在溶液中能大量共存的组别只有⑶⑷,故选B
第13题:根据有机物的结构特点, 链状分子中头与尾和支链只能接-CH3或氯原子,且
-CH3的数目+氯原子数目=![]() 数目+2,所以氯原子的个数为m+2-a,选B
数目+2,所以氯原子的个数为m+2-a,选B
第14题:A正确,因生铁是铁碳合金,易发生原电池吸氧腐蚀,故纯铁比生铁耐腐蚀;B错误, 甲苯应和液溴;C错误, 工业上冶炼铁是用CO作还原剂,铝热反应适宜冶炼难熔金属钒、铬、锰等。D错误使用正催化剂不能提高反应物的转化率,故选A。
第15题:A中电荷不平衡,B中原子数、电荷均不平衡,D中Al元素应以AlO2-存在。故正确答案应为C
第16题: 放电时正极反应(还原反应)应为FeO42—+ 3e—+ 4H2O = Fe(OH)3+ 5OH—
放电时每转移3moL电子,正极有1 mol K2FeO4被还原,故叙述不正确的是BC
第17题:反应后的溶液中C(Cl-)=0.1mol/L,C(Br-)=0.3mol/L,根据电荷守恒,溶液中必含有Fe2+、Fe3+,即只有部分Fe2+被氧化,又由于还原性Fe2+大于Br-,所以Br-完全未被氧化
通入的1.12L(0.05mol)Cl2只氧化0.1molFe2+生成0.1molFe3+,故原溶液的浓度为0.15mol/L, 反应后溶液中C(Fe3+)=0.1mol/L, 剩余C(Fe2+)=0.05 mol/L,故本题的正确选项为BD.
第18题: 混合后的溶液中存在的微粒(除水外)是HX(0.05mol/L), Na+ (0.05mol/L),
X- (0.05mol/L),根据物料守恒有C(HX)+C(X-)=2C(Na+)=0.1mol/L,根据电荷守恒有C(Na+)+C(H+)=C(X-)+C(OH-),若溶液呈碱性,说明X-的水解大于HX的电离,有C(HX) >C(Na+)> C(X-)>C(OH-)>C(H+),若溶液呈酸性,说明HX的电离大于X-的水解,有C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-),故本题选AC
第19题:(1)正确的是:A、E、F
B错,由于FeCl3水解产生Fe(OH)3和HCl,蒸干并灼烧时最后得Fe2O3, C错,用已知浓度的盐酸滴定未知浓度的氨水时,由于生成的NH4Cl水解显酸性,应选用甲基橙作指示剂.D错, 制Fe(OH)2时,为防止Fe(OH)2被氧化, 盛NaOH溶液的胶头滴管应伸入到试管底部挤出溶液
(2)实验目的:检验硫酸亚铁晶体是否被氧化
实验步骤①取少量晶体溶于水,加稀硫酸酸化
②将溶液分成两份于洁净的试管中,一份中滴加几滴KSCN溶液
③另一份中滴加适量KMnO4溶液;
结论:1.无血红色,且KMnO4溶液褪色,则说明未被氧化 2.有血红色,且KMnO4溶液褪色则说明部分氧化3.有血红色,但KMnO4溶液不褪色则说明完全被氧化。
第20题:
(1)烧瓶中放入几块碎瓷片的作用是防止暴沸,图中一处明显错误是温度计的水银球未插入反应液面下。
(2)若实验时看到G中澄清石灰水无明显现象但I中澄清石灰水混浊,请对出现该现象的原因提出一合理的猜想是:乙烯被酸性KMnO4溶液氧化生成了CO2。
(3)说明混合气体中含有CO2的现象是:C中品红不褪色,而D中澄清石灰水变浑浊说明混合气体中含有乙烯的现象是:G中澄清石灰水不浑浊,而H中酸性KMnO4溶液褪色。
(4)F中NaOH溶液的作用是:吸收混合气体中的SO2和CO2,
B中应盛放的试剂是: 溴水(选填“溴水”或“酸性高锰酸钾溶液”)。
第21题: A~I分别表示中学化学中常见的一些物质,它们之间相互关系如下图所示(部分反应物,生成物没有列出),已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: 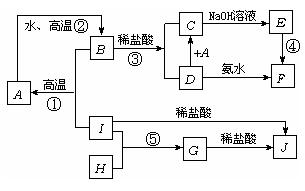
(6) A、B、C、D、E、F六种物质所含的同一种元素是:Fe;
(7) G、F的化学式分别是:Al2O3、 Fe(OH)3。
(8) 写出①②④反应的化学方程式:
①3Fe3O4+8Al ![]() 9Fe+4Al2O3
9Fe+4Al2O3
②3Fe+4H2O![]() Fe3O4+4H2↑
Fe3O4+4H2↑
④4Fe(OH)2+O2+2H2O=4Fe(OH)3
(9) G与NaOH溶液反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O
(10) 在①②③④⑤反应中,属于放热反应的是:①③④⑤。
第22题: (1)从开始反应至达到平衡状态,生成C的平均反应速率为0.2mol/L·min,X=4。
(2) ![]() >
>![]()
(3). 不移动
(4)再充入B 0.25amol n(A)=2.4+0.6a
![]()
该反应为3A(g)+ B(g)
XC(g),因该反应是一个反应前后化学计量数相等的反应,因此只要保持开始投料时n(A):n(B)=3:2 ,到达的平衡总是等效的(各物质的物质的量分数与原平衡相同), 若向原平衡混合物的容器中再充入amolC,按3:1折算成A和B,所以要再充入B,设为Ymol,则有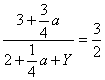 解得Y=0.25a,达新平衡时, A的物质的量为n(A)=0.8(
解得Y=0.25a,达新平衡时, A的物质的量为n(A)=0.8(![]() )=2.4+0.6a
)=2.4+0.6a
第23题.(1)反应中生成溴化氢的物质的量为n mol。
(2)消耗氧气7.5nmol
(3)![]()
第24题:(1)上述系列中第2种物质的分子式为C32H16
(2)质量比为51︰50。。
(3)(3)![]() -CH=CH2+Br2→
-CH=CH2+Br2→![]() -CHBr-CH2Br
-CHBr-CH2Br
![]() -CHBr-CH2Br+2NaOH
-CHBr-CH2Br+2NaOH![]()
![]() -C≡CH+2NaBr+2H2O
-C≡CH+2NaBr+2H2O
解析:第2种物质有4个苯环,共24个C原子,16个H原子;4个碳碳三键共8个C原子,故分子式为C32H16。芳炔类大环的通式为(C8H4)n,
nC8H6∶nC8H4=102n∶100n=51︰50。
(3)![]() -CH=CH2+Br2→
-CH=CH2+Br2→![]() -CHBr-CH2Br
-CHBr-CH2Br
![]() -CHBr-CH2Br+2NaOH
-CHBr-CH2Br+2NaOH![]()
![]() -C≡CH+2NaBr+2H2O
-C≡CH+2NaBr+2H2O
第25题: 答案(1)0.3≤V<0.42
(2)m(Cu)=3.2g或m(Cu)=14.4g
分析(1)发生的反应为Fe2O3+3 H2SO4=== Fe2( SO4)3+3 H2O
Cu+ Fe2( SO4)3=== Cu SO4+ 2Fe SO4
当固体恰好全部溶解时,必须满足n(Cu)≤n(Fe2O3),又当n(Cu)= n(Fe2O3)=![]() 时, 混合物粉末消耗H2SO4量最少为0.3mol,V(H2SO4)=0.3L;当全为Fe2O3时, n(Fe2O3)=
时, 混合物粉末消耗H2SO4量最少为0.3mol,V(H2SO4)=0.3L;当全为Fe2O3时, n(Fe2O3)=![]() ,消耗H2SO4量最多为0.42mol, V(H2SO4)=0.42L,
,消耗H2SO4量最多为0.42mol, V(H2SO4)=0.42L,
所以(1)0.3≤V<0.42
(2)根据Cu + Fe2( SO4)3=== Cu SO4+ 2Fe SO4
0.05mol 0.05mol 0.1mol
当Cu少时按Cu计算,m(Cu)= 3.2g
当Fe2O3少时,按Fe2( SO4)3计算,n(Fe2( SO4)3)=n(Fe2O3)= 0.05mol ,m(Fe2O3)=8g. m(Cu)=14.4g
第26题: (1)满足此条件的可能组别是①⑤⑥
(2) A为C2H6, B为C2H2, C为C4H8 , 按1:1:2混合后,平均分子式为C3H6,产生的CO2和H2O的物质的量之比为1:1,可求出n(CO2)=n(H2O)=0.015mol,n(C3H6)=0.005mol,
C3H6+4.5O2→3CO2+3H2O 当燃烧后的产物用过量碱石灰吸收后所剩气体为O2
V(O2)= 840-5.5×0.005×22400=224mL