玉林实验中学高二化学期末复习检测题
班级 姓名 成绩_________
一、单选题(本题包括20小题,每小题2分,共40分)
1、纯水在10℃和100℃时的pH,前者和后者的关系是:
A、前者大 B、前者小 C、相等 D、不能确定
2、把a、b、c、d四块金属板浸入稀H2SO4中,用导线两两相连可以组成原电池,若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c极上产生了大量气泡;b、d相连时,b极上有大量气泡产生,则四块金属的活动顺序为:
A.a>d>b>c B.a>c>d>b C.a>b>c>d D.b>d>c>a
3、在2A+B=3C+4D反应中,表示该反应速率最快的是:
A、v(A)=0.5mol·L—1·s—1 B、v(B)=0.3mol·L—1·s—1
C、v(C)=0.8mol·L—1·s—1 D、v(D)=1mol·L—1·s—1
![]() 4、在一定条件下,反应A(g)+2B(g) 3C(g)达到平衡的标志是
4、在一定条件下,反应A(g)+2B(g) 3C(g)达到平衡的标志是
A、容器内压强不再变化
B、单位时间内生成nmolA同时生成2nmolB
C、A、B、C浓度不再变化
D、A、B、C的分子数之比为1:2:3
5、0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN—)<C(Na+),则下列关系中,正确的是:
A、C(Na+)>C(CN—)>C( H+)>C(OH―) B、C(HCN)+C (CN—)=0.04mol·L—1
C、C(Na+)+C(H+)= C(CN—)+C(OH―) D、C(CN—)>C(HCN)
6、下列气体的制备可采用右图装置的是
A 铜与浓硝酸反应制NO2
B 铜与稀硝酸反应制NO
C 乙醇与浓硫酸反应制乙烯
D 氯化钠与浓硫酸反应制HCl
7、在体积可变的密闭容器中,反应mA(气)+nB(固)![]() pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是
pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是
A (m+n)必定小于p B (m+n)必定大于p
C m必定小于p D n必定大于p
8、将铁片放入下列各溶液中,反应后溶液质量增加,但无气体产生的是
A.CuSO4溶液 B.AgNO3溶液 C.FeCl3溶液 D.稀硫酸
9、在下列有机物中,能跟溴水发生加成反应,又能被酸性高锰酸钾溶液氧化的是
A.苯 B.甲苯 C.乙苯 D.苯乙烯
10、有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
11、下列烷烃的一氯代物没有同分异构体的是
A、2-甲基丙烷 B、丙烷 C、丁烷 D、乙烷
12、下列5种烃:①2-甲基丙烷;②乙烷;③丙烷; ④丁烷;⑤戊烷。按它们的沸点由高到低的顺序排列正确的是
A、①②③④⑤ B、⑤④①③② C、④⑤②①③ D、③①②⑤④
13、下列离子方程式错误的是
A. 明矾溶液中递加过量氨水:
Al3+ + 3NH3 H2O = Al(OH)3 ↓+ 3NH4+
B. 碳酸钡中加入稀盐酸
BaCO3 + 2H+ = Ba2+ + CO2↑ +H2O
C. 偏铝酸钠溶液中加入过量盐酸
AlO2- + 4H+ = Al3+ + 2H2O
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液
HCO3- + OH- = CO32- + H2O
14、两种气态烃组成的混和气体0.1mol完全燃烧得0.16摩尔CO2和3.6gH2O,下列说法正确的( )
A.一定有乙烯 B.一定是甲烷和乙烯
C.一定有乙炔 D.一定有甲烷
15、将适量的铁粉放入FeCl3溶液中,完全反应后,溶液中Fe2+和Fe3+的浓度相等,则已经反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A. 1:3 B.2:3 C.3:2 D.1:2
16、在pH=1的溶液中,可以大量共存的离子是
A Na+ K+ HCO3- Cl- B NH4+ Mg2+ SO42- Cl-
C K+ Na+ SO42- SO32- D K+ Na+ AlO2- NO3-
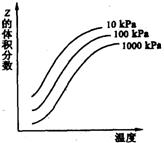 17、右图是温度和压强对X+Y
17、右图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A X和Y中只有一种为气态,Z为气态
B X、Y、Z均为气态
C 上述可逆反应的正反应为放热反应
D 上述可逆反应的逆反应为吸热反应
18、在Na2S溶液中存在的下列关系正确的是
A. c(Na+)=c(S2-) B. c(Na+)∶c(S2-)=2∶1
C. c(Na+)∶c(S2-)>2∶1 D. c(Na+)∶c(S2-)<2∶1
19、已知空气—锌电池的电极反应为:锌片:Zn + 2OH――2e-= ZnO + H2O
石墨:1/2O2+H2O + 2e- = 2OH- 据此判断:锌片是:
A. 负极,并被氧化 B. 负极,并被还原
C. 正极,并被氧化 D. 正极,并被还原
20、在氮的氧化物中,氮元素和氧元素的质量比是7:12,则氮元素的化合价为 ( )
A.+2 B.+3 C.+4 D.+5
二、填空题(每空2分,共24分)
21.有下列六种烃,甲烷、乙炔、丙烯、甲苯和苯,分别取一定量的某种烃完全燃烧生成A mol CO2和B mol H2O
⑴若A=B,该烃是
⑵若A=2B,该烃是
22.1mol某不饱和烃可以和2molH2 发生加成反应,生
成2,3-二甲基戊烷,则该不饱和烃的结构是
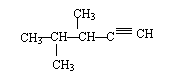
23、请写出下面结构简式的名称______________________

24、Mg(OH)2中混有的Al(OH)3的杂质可以用NaOH除去,请用离子方程式表示_______________________________
25、请完成并配平反应
(1) K2Cr2O7 + C + H2SO4 → Cr2(SO4)3 + K2SO4 + ___CO2 ↑+ _____H2O。
(2)若反应生成1mol CO2,则反应中有 mol Cr原子被还原,转移 mol电子。
26、(4分).现只有酚酞试液、试设计鉴别盐酸、氢氧化钠、硫酸钠三瓶溶液的实验方案:
。
27、有一包固体粉末可能含有Cu2+、Al3+、Mg2+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)溶液中加入Ba(NO3)2溶液,无沉淀生成,再滴入AgNO3溶液,有白色沉淀生成;
(3)再取少量固体加入适量蒸馏水,搅拌后,固体全部溶解,得到无色透明的溶液;
(4)向(3)溶液中加入氨水,使溶液呈碱性,有沉淀生成,过滤。向过滤所得沉淀中加入过量氢氧化钠溶液,沉淀部分溶解。
这包粉末中一定不含有的离了是___________________________,
肯定含有的离子是_______________________________________
三、推断题(6分)
28、右图中每一方框的字母代表一种反应物或生成物:
已知气态烃D(其密度在同温同压下是氢气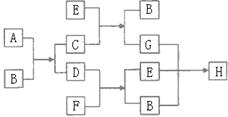 密度的13倍)跟物质F反应时产生明亮而带浓烈黑烟的火焰。请写出下列字母代表的物质的化学式(分子式):
密度的13倍)跟物质F反应时产生明亮而带浓烈黑烟的火焰。请写出下列字母代表的物质的化学式(分子式):
A 、B 、H 。
四、实验题(12分)
29.(22分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
 (1)在试管Ⅰ里加入的试剂是
。
(1)在试管Ⅰ里加入的试剂是
。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
五、计算题:(30题8分,31题10分,共18分)
30.将0.6 mol X气体和0.4 mol Y气体混合于2 L容器中使它们发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),5 min末时已生成0.2 mol W,若测知以Z浓度变化来表示化学反应速率为0.01 mol /(L·min)。求:
nZ(g)+2W(g),5 min末时已生成0.2 mol W,若测知以Z浓度变化来表示化学反应速率为0.01 mol /(L·min)。求:
(1) 以X的浓度变化来表示化学反应速率为多少?
(2) 反应中Z气体的化学计量数n的值是多少?
31.乙烯与乙烷混合气体共 a mol ,与 b mol 的氧气共存于一密闭容器中,点燃后充分反应,乙烯、乙烷和氧气全部消耗完,得到 CO 和 CO2 的混合气体和 45 g水。试求:
(1)当a=1时,乙烯与乙烷的物质的量之比 n(C2H4):n(C2H6)= ________
(2)当a=1,当乙烯与乙烷的物质的量之比第(1)问相同时,且反应后CO和CO2混合气体的物质的量之和为反应前氧气的2/3时,则b=_ _,得到的CO和CO2的物质的量之比为n(CO):n(CO2)=________
(3)a的取值范围是 ______________
答 案
1A 2B 3B 4C 5C 6B 7C 8C 9D 10C 11D 12B
13D 14D 15B 16B 17A 18C 19A 20B
21(1)丙烯(2) 乙炔,苯
 22、
22、
23、3,3,5—三甲基己烷 24、Al(OH)3 +OH-= AlO2- +2H2O
25、2,3,8,2,2,3,8 4/3 4
26、各取少量未知溶液分别装在三支试管中,各滴加2~3滴酚酞试液,溶液变红色的是氢氧化钠溶液;再将上述红色溶液分别倾倒少许到另两支试管,能使红色褪去的原溶液是盐酸;不能使红色褪去的原溶液是硫酸钠溶液。
27、(!)CO32- ,Cu2+ SO42- (2)Al3+、Mg2+、Cl-
28、A:CaC2 ,B:H2O F:O2 H:Ca (HCO3)2
29、方法一 (1)稀H2SO4 铁屑 (2)避免生成的 Fe(OH)2沉淀接触O2
方法二 (1)稀 H2SO4 铁屑 (2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。
30、0.03 mol /(L·min) n=1
31、(1) 1:1 (2)3 ,1:3 (3)3< b/a < 3.5