高二化学第二章化学平衡电离平衡复习题
一、选择题(每题有1-2个选项符合题意,每题2分,共50分)
![]() 1、在2L的密闭容器中,加入1mol和3mol的H2和N2,发生 N2 + 3H2 2NH3
1、在2L的密闭容器中,加入1mol和3mol的H2和N2,发生 N2 + 3H2 2NH3
在2s末时,测得容器中含有0.4mol的NH3,该反应的化学反应速率是( )。
A、V N2=0.1mol·L—1 B, V H2=0.15 mol·L—1
C, V N2=3 V H2=2V NH3 D, 3V N2= V H2=V NH3×3/2
![]() 2、可逆反应A(g)+3 B(g) 2C(g)+ D(g) 在四种不同情况下的反应速
2、可逆反应A(g)+3 B(g) 2C(g)+ D(g) 在四种不同情况下的反应速
率如下,其中反应进行得最快的是( )
A. VA==0.15mol ·(L·min)—1 B. VB==0.6 mol ·(L·min)—1
C. VC==0.4 mol ·(L·min)—1 D.VD==0.01 mol ·(L·s)—1
3、CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系
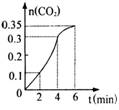 如图所示,下列结论不正确的是
( )
如图所示,下列结论不正确的是
( )
A、反应开始2分钟内平均反应速率最大
B、反应4分钟后平均反应速率最小
C、反应开始4分钟内温度对反应速率的影响浓度大
D、反应在第2min到第4min间消耗的CaCO3质量的20g
![]() 4、在2A+B 3C+4D反应中,表示该反应速率最快的是( )
4、在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A.V(A)=0.5 mol·L-1·s-1 B.V(B)=0.4 mol·L-1·s-1
C.V(C)=0.8 mol·L-1·s-1 D.V(D)=1 mol·L-1·s-1
5、在mA+nB==pC的反应中,(m,n,P为各物质的化学计量数)现测得C每分钟增加2mol , B每分钟减少3mol , A每分钟减少1 mol , 则m :n :p 为 ( )
A 2 :3 :2 B 2 :2 :3
C 1 :3 :4 D 1 :3 :2
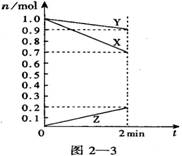 6、某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线图2—3所示。由图中数据分析,该可逆反应的化学方程式为:
6、某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线图2—3所示。由图中数据分析,该可逆反应的化学方程式为:
![]()
![]() A、3X+2Y 2Z B、Y+3X 2Z
A、3X+2Y 2Z B、Y+3X 2Z
![]()
![]() C、2Z
3X+Y D、3Y+X Z
C、2Z
3X+Y D、3Y+X Z
7、某温度下,体积为2L的容器,分别放入1 mol的
三种气体X2、Y2、Z2,在密闭容器中反应,
经过t min后,测得物质的浓度分别为:
c(X2)=0.4 mol·L-1,c(Y2)=0.8 mol·L-1,
c(Z2)=0.6 mol·L-1,
则该反应的反应式可表示为:( )
![]()
![]()
![]() A.X2+2Y2
2Z
2 B.2X2+4Y2 3Z2
A.X2+2Y2
2Z
2 B.2X2+4Y2 3Z2
![]()
![]() C.X2 Z2 +3Y2 D.X2 2Z 2+3Y2
C.X2 Z2 +3Y2 D.X2 2Z 2+3Y2
8、20℃时,将Na2S2O3溶液10 mL和HCl溶液10 mL混合,4 min后溶液中明显出现浑
浊,已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃时,同样的反
应要看到同样的浑浊,需要的时间是( )
A.40 s B.15 s C.48 s D.30 s
9、可逆反应N2+3H2 ![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来
表示。下列各关系中能说明反应已达到平衡状态的是 ( )
A.3v正(N2)==v正(H2) B.v正(N2)==v逆(NH3)
C.2v正(H2)==3v逆(NH3) D.v正==3v逆(H2)
10、对已达化学平衡的下列反应2X(g)+Y(g)![]() 2Z(g)减小压强时,对反应产生影
2Z(g)减小压强时,对反应产生影
响的是 ( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率增大,平衡向正反应方向移动
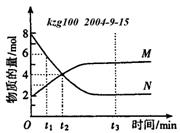 11、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
11、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
下列表述中正确的是 ( )
A. 反应的化学方程式为:2M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C、t3时,正反应速率大于逆反应速率
D、t1时,N的浓度是M浓度的2倍
12、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是 ( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
13、![]() 恒温恒压下,在容积可变的器皿中,反应2NO2(气) N2O4(气)达到平衡后,
恒温恒压下,在容积可变的器皿中,反应2NO2(气) N2O4(气)达到平衡后,
再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
14.把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:
![]() 3A(气)+B(气) 2C(气)+xD(气);正反应为放热反应,5min达平衡,此
3A(气)+B(气) 2C(气)+xD(气);正反应为放热反应,5min达平衡,此
时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是( )
A.降低平衡体系的温度,逆反应速率变小,正反应速率增大,平衡正向移动
B.恒温下达到平衡的标志是C和D的生成速率相等
C.A的平均反应速率为0.15mol·(L·min)-1 D.B的转化率为25%
![]() 15、反应A(g)+xB(g) yC(g),将A与B按体积比1:x混合反应当A的转化率是50%时,反应后的压强是反应前压强的
15、反应A(g)+xB(g) yC(g),将A与B按体积比1:x混合反应当A的转化率是50%时,反应后的压强是反应前压强的![]() (同温同体积),则x、y的值可能是
(同温同体积),则x、y的值可能是
A、3,4 B、3,2 C、3,3 D、1,1
16、将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A.c(HCN)<c(CN-) B.c(Na+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN) +c(CN-)==0.1mol·L-1
17、在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B.甲烧杯中的酸过量 C.两烧杯中参加反应的锌等量
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
18、将0.1mol/L醋酸溶液加水稀释,下列说法正确的是 ( )
A.溶液中c(H+)和c(OH—)都减小 B.溶液中c(OH-)增大
C.醋酸电离平衡向左移动 D.溶液的PH增大
19、物质的量浓度相同的下列溶液中,符合按PH由小到大顺序排列的是 ( )
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3m NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
20、将0.1mol.L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,会引起
A.溶液的pH增加 B.CH3COOH电离度变大
C.溶液的导电能力减弱 D.溶液中[OH-]减小
21、室温下,在pH=12的某溶液中,由水电离的C(OH-)为 ( )
A.1.0× 10-7mol·L-1 B.1.0× 10-6mol·L-1
C.1.0×10-2mol·L-1 D.1.0×10-12mol·L-1
22、下列物质的水溶液能导电,但属于非电解质的是 ( )
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
23、用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C. 用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸
馏水进行滴定
D.用酚酞做指示剂滴至无色刚变红色时即停止加盐酸。
24、有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全
部流下排出,用量筒承接,该溶液的体积应为( )
A、10mL B、40mL C、大于40mL D、小于40mL
25、用相同物质的量浓度的盐酸、硫酸、磷酸溶液,分别中和体积相同,浓度相同的氢氧
化钠溶液生成正盐,消耗这三种酸的体积比是( )
A、1:1:1 B、3:2:1 C、6:3:2 D、1:2:3
二、填空题(
![]() 26、某温度时,容积不变的容器中A+B 2C反应达到平衡状态,若升高温度C的
26、某温度时,容积不变的容器中A+B 2C反应达到平衡状态,若升高温度C的
浓度增大,则正反应为 吸 热反应;如果A为气态,且增大压强平衡时A的含量增
大,则B为 固 态或 液 态,C为 气 态,如A为气体,加压时B的量不变,则B为
气 态,C为 气 态。
![]() 27、t0C在VL密闭容器中加入2mol N2和6mol H2,当反应N2+3H2 2NH3达平
27、t0C在VL密闭容器中加入2mol N2和6mol H2,当反应N2+3H2 2NH3达平
衡时,混合气体中N2、H2、NH3分别为A、B、Cmol,仍在t0C,若只改变起始物的加入量,但要维持A、B、C值不变,则在N2、H2、NH3的加入量用X、Y、Z表示,应满足的条件是
(1)若X=0,Y=0,则Z=___4_mol_
(2)若X=0.75mol,则Y=__2.25moL_Z=___2.5_mol___
(3)X、Y、Z应满足的一般条件,用X、Y、Z的方程式表示式是
__X+Z/2=_2_____、_Y+Z×3/2=6____。
28、中和滴定过程中,容易引起误差的五个方面,根据题意,用“偏高”,“偏低”或“无
影响”填空:
| 操 作 分 类 | 操 作 | C误差 |
| 仪器润洗 | 滴定管用蒸馏水冲洗后,未用标准溶液润洗 | 偏高 |
| 取待测液滴定管用蒸馏水冲洗后,未用待测液润洗 | 偏低 | |
| 锥形瓶用蒸馏水冲洗后,再用待测液润洗 | 偏高 | |
| 气泡 | 滴定管尖嘴部分滴定前有气泡,滴定终了无气泡 | 偏高 |
| 滴定管尖嘴部分滴定前无气泡,滴定终了有气泡 | 偏低 | |
| 读数 | 滴定前平视滴定管刻度线,滴定终了俯视刻度线 | 偏低 |
| 滴定前仰视滴定管刻度线,滴定终了俯视刻度线 | 偏低 | |
| 滴定和 终点判断 | 在滴定过程中,向锥形瓶中添加少量蒸馏水 | 无影响 |
| 滴定时,振荡不当,有少量待测的碱液溅出 | 偏低 | |
| 盐酸滴定氢氧化钠时酚酞变成红色但很快退色。 | 偏低 | |
| 滴定结束,滴定管尖端挂一滴液体未滴下 | 偏高 |
![]() 29、根据NH2·H2O的电离方程式 NH2·H2O NH4++OH— 。
结合变化量填下表。
29、根据NH2·H2O的电离方程式 NH2·H2O NH4++OH— 。
结合变化量填下表。
|
 | H2O | NH4Cl (s) | NaOH (s) | HCl (1) | ||||||||||||||||||
| (1)n (OH-) | 增大 | 减小 | 增大 | 减小 | ||||||||||||||||||
| (2)c (OH-) | 减小 | 减小 | 增大 | 减小 | ||||||||||||||||||
| (3)平衡移动方向 | 右 | 左 | 左 | 右 | ||||||||||||||||||
| (4)PH值 | 减小 | 减小 | 增大 | 减小 |
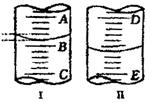 30、如图(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为6,量筒中液体体积是 5.2 mL。
30、如图(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为6,量筒中液体体积是 5.2 mL。
(2)图II表示50mL滴定管中液面的位置,如果液面处的
读数是a,则滴定管中液体的体积(填代号) D 。
A.是a mL B.是(50-a)mL
C.一定大于a mL D.一定大于(50-a)mL
31、某可溶性盐的化学式X2Y,将一定量的该盐溶于适量的
水中。
(1)若测得溶液的pH为3,则该盐与水反应的离子方程式可能为
![]() X++H2O
XOH+H+
。
X++H2O
XOH+H+
。
(2)若该盐水溶液的pH为11,则其与水反应的离子方程式可能为
![]() Y2—
+ H2O
HY—+OH—
Y2—
+ H2O
HY—+OH—
32、常温下,纯水中C(H+)=1×10-7mol/L。则此时纯水中的C(OH-)= 1×10-7 mol/L滴入
盐酸使C(H+) =5 ×10-6mol/L,则水电离出的C(OH-)=_2×10-9mol/L。加入氢氧化
钠使C(OH—)=5 ×10-6mol/L,则Kw= 1×10-14,加入碳酸钠使水的PH值为10,
则上述物质能抑制水的电离的是盐酸、氢氧化钠,能促进水的电离的是碳酸钠 ,
三、计算题
33、量取25.00mL未知浓度的硝酸溶液,用去10.50mL浓度为0.120mol·L-1NaOH溶液进行滴定后,又再用去14.50mL浓度为0.120mol·L-1的KOH继续滴定恰好完全反应,求该HNO3溶液的物质的量浓度是多少?(0.120mol·L-1)
