浏阳一中高二毕业会考化 学 试 题
本试题分第 I卷(选择题)和第II卷(非选择题)两部分,共100分,考试时间90分钟。
原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32
Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 Zn 65 Ag 108 Ba 137
第 I卷(选择题)
一、单项选择题(每小题2分,共50分)下列各题均只有一个符合题意的答案,多选、错选均不得分。将答案的字母代号填写在括号内。
1.据报道,科学家发现了一种新元素,它的原子核内有161个中子,质量数为272,该元素的原子序数为 ( )
(A)111 (B)161 (C)272 (D)433
2.下列各仪器中,可以直接在酒精灯火焰上加热的仪器是 ( )
(A)集气瓶 (B)量筒 (C)试管 (D)烧杯
3.氯化钠在无色火焰上灼烧时,火焰呈 ( )
(A)红色 (B)黄色 (C)紫色 (D)绿色
4.下列各组离子在水溶液中,能大量共存的离子组是 ( )
(A)Na+、Ca2+、HCO3-、OH- (B) K+、Na+、NO3-、CO32-
(C)Mg2+、K+、HCO3-、H+ (D) K+、NH4+、S2-、OH-
5.氟里昂是一种最好的冰箱制冷剂之一,但现在世界上很多国家已禁止使用,因为它会污染空气,引起 ( )
(A) 臭氧层破坏 (B)温室效应 (C)酸雨 (D)光化学烟雾
6.下列变化中,属于化学变化的是 ( )
(A)石油分馏 (B)碘片升华 (C)煤的干馏 (D)食盐溶于水
7.第三周期的非金属元素对应的含氧酸中,酸性最强的是 ( )
(A)硫酸 (B)磷酸 (C)硅酸 (D)高氯酸
8.下列物质中与CH3—CH2—CH2—CH3互为同分异构体的是 ( )
(A)CH2=CH-CH=CH2 (B)CH2=CH-CH2—CH3
(C)CH3—CH—CH3 (D)CH![]() C—CH2—CH3
C—CH2—CH3
CH3
9.氯化钠的电子式正确的是 ( )
(A)NaCl (B)![]() (C)
(C)![]() (D)Na+[Cl-]
(D)Na+[Cl-]
10.下列关于氯气的叙述中,错误的是 ( )
(A)是无色气体 (B)是一种有毒气体
(C)红热的铜丝能在氯气中燃烧 (D)氯气能使湿润的红色布条褪色
11.下列有关硫元素的单质及其化合物的叙述中,错误的是 ( )
(A)硫不能在空气中燃烧 (B)硫通常是一种淡黄色的晶体
(C)硫化氢是有臭鸡蛋气味的气体 (D)硫化氢具有还原性
12.常温常压下,燃烧相同物质的量的下列气体,生成CO2最多的是( )
(A)CH4 (B)C2H2 (C)C2H4 (D)C3H4
13. 下列有关硝酸的叙述中,错误的是 ( )
(A) 无论是浓硝酸还是稀硝酸都有氧化性
(B) 常温下铝和铁在浓硝酸中和稀硝酸中都会发生钝化
(C) 铜和稀硝酸反应有一氧化氮气体生成
(D) 碳酸钙和足量稀硝酸反应放出二氧化碳气体
14.按周期表中碱金属元素从上到下顺序排列,下列描述错误的是 ( )
(A)原子的最外层电子数逐渐增多 (B)原子的电子层数逐渐增多
(C)原子失去电子的能力逐渐增强 (D)元素的金属性逐渐增强
15.既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是 ( )
(A)Fe2O3 (B)MgO (C)Al2O3 (D)CuO
16.下列各有机物中,能发生银镜反应的是 ( )
(A)乙醇 (B)乙醛 (C)乙酸 (D)乙烷
17.结构简式为CH2=CH CH2 CH2 OH的有机物,不能发生的反应是
( )
(A) 加成反应 (B) 消去反应
(C) 酯化反应 (D) 水解反应
18.下列反应中,通常用于实验室制取氯化氢气体的是 ( )
(A)氯化钡溶液与稀硫酸反应 (B)氢气在氯气中燃烧
(C)氯化钠固体与浓硫酸反应 (D)氯气与水反应
19.下列各组气体,通常情况下能共存,并都能用浓硫酸或碱石灰干燥的一组气体是 ( )
(A) H2、O2、CH4 (B)N2、H2、NH3
(C) Cl2、CO2、HCl (D)H2S、SO2、O2
20.氢负离子(H -)能与NH3 反应: NH3 + H-== NH2- + H2 ,由此得出的结论正确的是 ( )
(A) NH3是还原剂 (B)该反应为置换反应
(C) NH2-是还原产物 (D)H -具有较强的还原性
21.在含有a g HNO3的稀硝酸中,加入b g 铁粉恰好完全反应。硝酸的还原产物为NO,已知有a / 4 g HNO3被还原,则 a :b不可能是 ( )
(A)2 :1 (B)3 :1 (C)4 :1 (D)9 :2
22.向某溶液中加入少量AgNO3 溶液,生成淡黄色沉淀,过滤出沉淀,在滤液中加入 KSCN溶液,不显红色,再加入氯水,溶液变红色,则该溶液是 ( )
(A) CaBr2溶液 (B) FeCl2溶液
(C) FeBr2溶液 (D) FeCl3溶液
23.下列反应的离子方程式书写错误的是 ( )
(A)盐酸跟氢氧化钠溶液反应: H+ + OH -= H2O
(B)硝酸跟碳酸钠溶液反应: 2H+ + CO2-3 = CO2↑ + H2O
(C)氯化钠溶液跟硝酸银溶液反应: Ag+ + Cl - = AgCl↓
(D)盐酸跟氢氧化铜反应: H+ + OH - = H2O
24. 在Fe2(SO4)3和FeSO4 的混合物中,已知硫元素的质量分数为23.6%,则混合物中铁元素的质量分数为 ( )
(A) 23.6% (B) 47.2%
(C) 29.2% (D) 70.8%
25.含杂质的碳酸钙样品(杂质不与酸反应)12.5g与足量的盐酸反应,得到二氧化碳4.4g,则样品中CaCO3的质量分数为 ( )
(A)60% (B)80% (C)85% (D)90%
浏阳一中高二会考化学答题卷
班次 姓名 学号 计分
选择题答案栏:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
| |||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 21 | 22 | 23 | 24 | 25 | ★ | ★ | ★ | ★ | ★ |
| 答案 |
|
|
|
|
| ★ | ★ | ★ | ★ | ★ |
第 II卷(非选择题)
二、填空题(本题包括5小题,共20分)
26.配平下列氧化还原反应方程式,并填空:(5分)
Cu + HNO3(稀) == Cu(NO3) 2 + NO↑ + H2O
其中氧化剂是 氧化产物是 。
若生成1mol NO气体,则反应中转移了 mol电子。
27.X、Y、Z三种元素,它们都是短周期元素,且原子序数依次增大,X的一种原子现用作原子量的标准,Y原子核外共有8个电子,Z 是它所属周期中金属性最强的元素,可以和Y 形成化合物Z 2Y和Z 2Y2。则:(6分)
1)X、Y、Z的元素符号分别是:
X、 Y、 Z、 。
2)Z 2Y2和XY 2反应的化学方程式是:
。
3) Z元素的原子结构示意图为 。
4)化合物Z 2Y的电子式为 。
28.已知某有机物的分子量为58。若该有机物为烃,则分子式为 ;. 可能的结构简式为 或 ,若该有机物分子中有一个甲基,且为烃的含氧衍生物,则其可能的结构简式为 或
。(5分)
29.由钠、镁、铝、铁四种金属中的两种组成的混合物12g,与足量盐酸反应生成氢气0.5 g,则该混合物中一定含有的金属是 。(2分)
30.我国研究的高温超导材料中,铊(Tl)是重要成分之一,已知铊与铝是同主族元素,写出铊与盐酸反应的化学方程式:(2分)
.。
三、推断题(本题包括2小题,共8分)
31.A、B、C、D四支试管中分别盛有溴化钾、硝酸银、氯化铜、氢氧化钠四种溶液中的一种。现观察到A试管中的溶液为蓝绿色,再将A分别加入到其余三支试管中,观察到的现象如下:(4分)
1)A + B——无明显现象 2)A + C——出现蓝色沉淀
3)A + D——出现白色沉淀
根据上述现象可知,四支试管中所盛溶液中的溶质(填化学式)分别是:
A、 B、 C、 D 。
32.已知一种具有水果香味的有机物M的分子式为C4H8O2,M在一定条件下可进行如图所示的转化:(4分)
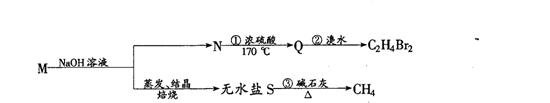
则:1)M的结构简式是 。
2)反应①的类型为 反应。 3)反应②的类型为 反应。
4)反应②的化学方程式为: 。
四、实验题(本题包括2小题,共8分)
33.下列三组无色气体:① CO和HCl;② SO2和CO2;③ NH3和N2。
可用品红溶液鉴别的一组气体是 。
可用湿润的红色石蕊试纸鉴别的一组气体是 。
剩下的一组气体可用 试纸鉴别。 (3分)
34.下图是实验室常见的几种实验装置:
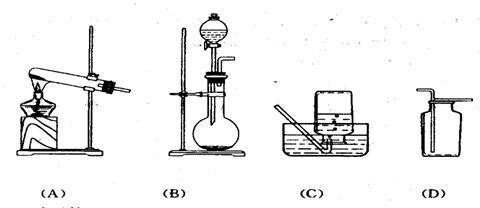
试回答:(5分)
1)实验室制取甲烷时,应将装置 与装置 相连(填序号)。
2)实验室制取甲烷时发生的反应的化学方程式为:
。
3)点燃甲烷前,必须 。.
4) 将甲烷在空气中点燃,甲烷燃烧的火焰呈 色。
5)收集甲烷气体时,还可用 方法收集。
五、计算题(本题包括2小题,共14分)
35.有Na2SO4 和Na2CO3的混合溶液10 ml,加入足量BaCl2溶液,充分反应后,经过滤、洗涤和烘干,得到白色沉淀1.451g。将沉淀与过量盐酸充分反应后,得到112 mlCO2气体(标况)。求原混合溶液中Na2SO4 和Na2CO3的物质的量浓度。(式量:BaSO4 233 BaCO3 197)(6分)
36.在标准状况下,将H2S和O2的混合气体a L在一个容积可变的密闭容器中点燃,充分反应后,恢复原来的温度和压强。若用V(H2S)和V(O2)分别表示原混合气体中所含H2S和O2的体积,用V表示反应后气体的体积(不考虑气体在水中的溶解)。 试求: (8分)
1)当V = 0时, V(O2) = L。 当V(O2) = 3a /5 L时,V = L。
2)当V = 3a /5 L时,计算原混合气体中V(H2S)和V(O2)之比可能是多少?
浏阳一中 闵家富 E-mail: