氮 族 和 化 学 平 衡 检 测
班级: 学号: 姓名:
一、每小题只有一个正确答案
1、本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
2、在日光的照射下,下列物质不发生化学变化的是
A、浓HNO3
B、H2和N2的混合气 C、溴化银 D、氯水
3、在一密闭烧瓶中,在25℃时存在着平衡:2NO2 ![]() N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
A ①和③ B ②和④ C ④和⑤ D ③和⑤
4、实验室存放下列药品的方法错误的是
A、少量白磷贮存在水中 B、水玻璃贮存在带玻璃塞的玻璃瓶中
C、液溴贮存在水中 D、浓硝酸贮存在棕色的细口玻璃瓶中
5、在一定条件下,反应A2(g)+B2(g) ![]() 2AB(g)达到平衡状态的标志是
2AB(g)达到平衡状态的标志是
A.单位时间内生成n mol A2的同时,生成n mol的AB
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.单位时间内,生成n mol A2的同时,生成n mol的B2
6、标准状况下,在三个干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4:1),然后分别以水作溶剂作喷泉实验。实验结束后三个烧瓶中所得溶液的物质的量浓度之比为
A 2:1:2 B 5:5:4 C 1:1:1 D无法确定
7、有关合成氨工业的说法中,正确的是
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~ 5×107Pa,因在该压强下铁触媒的活性最大
8、对已达化学平衡的下列反应:2X(g)+Y(g) ![]() 2Z(g)减小压强时,对反应产生的影响是
2Z(g)减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
9、在一定温度下将1molCO和1molH2O(g)通入一个密闭容器中反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
A.等于0.6mol B.等于1mol C.大于1mol D.大于0.6mol,小于1mol
10、在密闭容器中进行如下反应:N2+3H2 ![]() 2NH3(正反应放热),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
2NH3(正反应放热),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
(1)平衡不发生移动 (2)平衡沿着正反应方向移动(3)平衡沿着逆反应方向移动
(4)NH3的质量分数增加(5)正逆反应速率都增大
A.(1)(5) B.(1)(2)(5) C.(3)(5) D.(2)(4)(5)
11、含有硫酸铵和硝酸铵的混合溶液AL,加入amolNaOH,刚好使氨气全部逸出,加入bmolBaCl2,刚好使SO42-离子全部沉淀,则混合溶液中硝酸铵的物质的量浓度是
A、a/Amol/L
B、A/bmol/L
C、(a-2b)/A
mol/L D、(a-b)/A mol/L
12、某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入2.56克Cu粉,待充分反应后,溶液中Cu2+物质的量浓度为
A 0.15mol/L B 0.3mol/L C 0.225mol/L D 无法计算
二、选择题(每小题有1~2个正确答案)
13、下图表示的平衡混和物中,产物X的百分含量在不同压力下随温度改变的情况,在下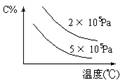 述哪一个可逆体系中X可代表用横线标明的物质
述哪一个可逆体系中X可代表用横线标明的物质
A N2(g)+O2(g) ![]() 2NO(g)(正反应吸热)
2NO(g)(正反应吸热)
B 2SO3(g) ![]() 2SO2(g)+O2(g)(正反应吸热)
2SO2(g)+O2(g)(正反应吸热)
C N2(g)+3H2(g) ![]() 2NH3(g)(正反应放热)
2NH3(g)(正反应放热)
D 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g)(正反应放热)
2N2(g)+6H2O(g)(正反应放热)
14、 0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
15、两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,在B中充入SO2和O2各2 mol,加热到相同温度,有如下反应2SO2(g)+ O2(g) ![]() 2SO3(g),对此反应,下述不正确的是
2SO3(g),对此反应,下述不正确的是
A.反应速率B>A B.SO2的转化率B>A
C.平衡时各组分含量B = A D.平衡时容器的压强B>A
16、已知碱能除去硝酸尾气:NO+NO2+2NaOH
2NaNO2+H2O。根据硝酸尾气处理的反应原理,下列气体中不可能被过量的NaOH溶液吸收的
A.1molO2和4molNO2
B.1molNO和4molNO2
C.1molO2和4molNO
D.4molNO和1molNO2
17、氢叠氮酸HN3与氢卤酸相似,它是易挥发的弱酸,下列叙述中不正确的是
A 它的水溶液中存在着N3-离子 B 是无色、有刺激性气味的气体
C NaN3与稀硫酸作用生成HN3 D 它与氨作用生成的是共价化合物
18、某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Zn2+、SO42-
B.MnO4-、K+、Cl-、H+、SO42-
C.Na+、Ba2+、NO3-、HCO3-、SO42- D.K+、NO3-、SO42-、OH-、Na+
三、简答填空
19、 NO分子对空气会造成污染。近年来发现少量的NO在生物体内许多组织中存在。它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学研究的热点。请回答下列问题:
(1)NO对环境危害在于_______________
A 破坏臭氧层 B 高温下使一些金属氧化
C 造成酸雨 D 与人体血液中血红蛋白结合造成缺氧
(2)在含Cu+的酶的活化中心中,亚硝酸离子( NO2-)可转化为NO。写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:
___________________________________________
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到500C,发现气体的压力迅速下降,但压力降至略小于原压力的2/3就不再改变。已知其中一种产物为N2O,试写出上述变化的化学方程式:
______________________________________ _
(4)用化学方程式解释(3)中为什么最后的气体总压力小于原压力的2/3?
20、在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) ![]() 3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是 (用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为 mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比
(选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C mol。
21、我们用字母L、M、Q、P、R、X分别代表五种含不同化合价的氮元素的物质,并且每种物质中氮元素的化合价只有一种,又知道物质L中的氮元素的化合价要比物质M中氮元素的化合价低,并且在一定条件下,它们会有如下的相互转换关系(未配平)
Q + HCl → M +Cl2 R
+ L → X + H2O R + O2 → L + H2O
请判断:(1)已知这五种物质中有一种是硝酸,那么硝酸应该是L、M、Q、R、X中的_________(填字母),判断的依据是________________________________
___
(2)反应③是在催化剂(如铂、氧化铁等)存在,并且加热到一定温度下反应,这个反应在工业上有重要的作用,若物质X是密度比CO2小的气体,X的分子式是________
(3)某同学写出下面三个不同价态的氮的化合物相互转换的关系(未配平)、
A.NO+HNO3 → N2O3+H2O B.NH3+NO → HNO2+H2O
C.N2O4+H2O → HNO3+HNO2
其中一定不可能实现的是____(填编号)
22、已知硫化氢与甲烷一样可在空气中燃烧,当氧气足量时其燃烧产物之一为二氧化硫。下列转化关系中A是一种正盐,D的相对分子质量比C大16,E是酸。X无论是强酸(非氧化性酸)还是强碱时都有如下转化关系(其它产物及条件均已略去):
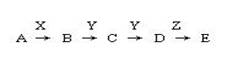
当x是强酸(非氧化性酸)时,A、B、C、D、E均含有同一种元素;当x是强碱时,A、B、C、D、E均含有另一种元素。
回答下列问题:
(1)A是 ,Y是 ,Z是 (填化学名称)。
(2)当X是强酸时,B的摩尔质量为34g/mol,E是 (填化学式),C→D的化学方程式是
。
(3)当X是强碱时,E是
(填化学式),B→C的化学方程式是
。
23、有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保 持内外压强相等.在相同条件下将3molA,1molB分别同时混合于a、b两容器中,发生反应3A(g )+B(g) ![]() 2C(g)+D(g)
2C(g)+D(g)
(1)达平衡时,a中A的浓度为M mol·L-1,C的浓度为N mol·L-1,b中A的浓度为m mol·L-1,C的浓度为n mol·L-1,则M m;N
n;(填>、<、=、无法比较)
(2)保持温度不变,按下列配比分别充入a、b两容器,达平衡后a中c的浓度为N mol·L- 1的是( ),b中c的浓度为n mol·L-1的是( )
A.6molA+2molB B.3molA+2molC C.2molC+1molB+1molD
D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD
(3)若将2molC和2molD充入a中,保持温度不变,平衡时A的浓度为Wmol·L-1,C的浓
度为Ymol·L-1,则W和M,Y和N之间的关系为W
M、Y
N.
(4)保持温度不变,若将4molC和2molD充入a中,平衡时A的浓度为Rmol·L-1则 ( )
A. R=2M
B.R<M
C.M<R<2M
D.R>2M
四、计算
24、将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO,NO2的体积各为多少升?
(2)待产生的气体全部释放后,向溶液加入V mLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为多少?
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水的质量为多少?。
氮 族 和 化 学 平 衡 检 测参考答案
1、 C
2、 B
3、 D
4、 B
5、 C
6、 B
7、 B 由于分离出氨,N2、H2循环使用,故产率较高。
8、 C
9、 D 再通入4molH2O(g)后使H2O(g)浓度增大,平衡向正确反应方向移动,所以CO2的物质的量增大,即n(CO2)>0.6mol。应用极端假设法,假设通入4molH2O(g)后,1molCO全部消耗掉,则转化为CO21mol,而实际上可逆反应达到平衡时CO的物质的量大于0,CO不可能全部消耗掉,故n(CO2)<1mol,即0.6mol<n(CO2)<1mol。
10、 D
将平衡体系中各物质的浓度都增加到原来的2倍,相当于增大压强1倍
11、 C
12、 B
13、 D
14、 bC
15、 C
16、 D
17、 D
18、 AD
19、 (1) A、C、D, (2)Cu+ + NO2- + 2H+ = Cu2+ + NO↑ + H2O
(3)3NO ![]() N2O
+ NO2 2NO2
N2O
+ NO2 2NO2 ![]() N2O4
N2O4
20、(1)25a% (2)2a 不变 (3)6
解析:(1)根据反应方程式,由生成了amolC,可知A反应了a/3mol,B反应了 2a/3mol,平衡时A为(1-a/3)mol,B为(3-2a/3)mol,C为amol,可计算出C的体积分数为25a%。(2)本题达平衡时与(1)小题达平衡时,互为等效平衡。则相同组分的体积分数相同,C的物质的量为2amol。(3)据恒温恒容下反应前后气体分子数不变的同一可逆反应的等效平衡规律,即通过反应的化学计量数比换算(极限假设转换)成反应式同一侧的反应物或生成物,其物质的量之比相同,二平衡等效,可设加入C xmol,xmolC完全换算成A、B后共有(2+x/3)molA,(8+2x/3)molB,由(2+x/3):(8+2x/3)=1:3,解得x=6。
21、(⑴Q 根据题给的关系,可以判断各物质中的氮元素的化合价高低顺序是R﹤X﹤L﹤M﹤Q,而HNO3中的N是氮元素的最高价态) ⑵ N2
⑶ b
22、(1)硫化铵 氧气 水 (2)硫酸 2SO2+O2![]() 2SO3
(3)HNO3 4NH3+5O2
2SO3
(3)HNO3 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
23、 (1)<;< (2)DE;ADE (3)W>M;Y<N (4)C
24、(1)5.8
5.4 (2)![]() (3)57.8
(3)57.8
