华中师大一附中2005—2006学年度第一学期
高二年级期末检测化学试题
时间:90分钟 总分:110分 命题人:熊定湖
可能用到的相对原子质量:H-1 O-16 Cl-35.5 Fe-56 Na-23 Mg-24 Al-27 Cu-64
一、选择题(3×20=60,每小题只有一个正确答案)
1、金属活动性的强弱与人类开发利用这些金属单质的时间顺序有着某种内在的联系。由此推断,下列金属中人类开发利用最晚的是:
A. Cu B.Fe C.Zn D.Al
2、NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关地叙述不正确地是:
A.降低压强能加快化学反应速率 B.使用适当地催化剂可以加快化学反应速率
C.升高温度能加快化学反应速率 D.改变压强对NO转化率没有影响
3、体积相同、pH值相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量:
A.相同 B.HCl多 C. CH3COOH多 D.无法比较
4、CH3COOH溶液与NaOH溶液反应,若反应后溶液的pH值为7,那么:
A. CH3COOH与NaOH的质量相等 B. CH3COOH和NaOH的物质的量相等
C. NaOH过量 D. CH3COOH过量
5、 ![]() 在新制的氯水中存在平衡:Cl2+H2O H++Cl-+HClO。若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是:
在新制的氯水中存在平衡:Cl2+H2O H++Cl-+HClO。若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是:
A.pH值增大,HClO浓度减小 B.pH值减小,HClO浓度增大
C.pH值增大,HClO浓度增大 D.pH值减小,HClO浓度减小
6、下列各组溶液中,不用任何其它试剂不能鉴别的是:
A.NaHSO4 MgSO4 Na2CO3 NaOH B.HCl NaOH K2SO4 NaHCO3
C.NaAlO2 KHCO3 NaCl NaHSO4 D.NaOH FeCl3 MgCl2 K2SO4
7、下列离子方程式正确的是:
A.氢氧化铁中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.铝粉溶于氢氧化钠溶液中:Al +2OH- =AlO2- +H2↑
C.在酸性的硫酸亚铁溶液中加入双氧水:2Fe2+ +H2O2 +2H+=2Fe3+ +2H2O
D.硫化氢气体通入氯化铁溶液中:Fe3+ +H2S =Fe2+ +S↓ +2H+
8、常温时,0.1mol/LHA溶液的pH>1,0.1mol/LBOH溶液中c(OH-):c(H+)=1012,将这两种溶液等体积混合,以下离子浓度关系正确的是:
A. c(H+)<c(OH-)<c(A-)<c(B+) B. c(OH-)< c(H+)< c(B+) <c(A-)
C. c(A-)= c(B+)> c(H+)= c(OH-) D. c(OH-)< c(H+)< c(A-)< c(B+)
![]() 9、已知反应:3A(g)+B(g) C(s)+4D(g),
9、已知反应:3A(g)+B(g) C(s)+4D(g),![]() .图中a、b曲线表示在一定条件下,D的体积分数随着时间的变化情况。若使曲线b变成曲线a,可以采取的措施是:
.图中a、b曲线表示在一定条件下,D的体积分数随着时间的变化情况。若使曲线b变成曲线a,可以采取的措施是:
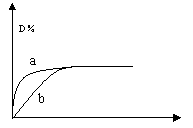 |
A.升高温度
B.缩小反应容器的体积
C.增加C的质量
D.减小B的浓度
|
![]() 10、某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g), 5分钟后达到平衡,各物质的平衡浓度的关系为:[c(A)]a·c(B)=c(C) ·c(D)。此时若在温度不变的情况下将容器扩大为原来的10倍,A的转化率不发生变化,则B的转化率为:
10、某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g), 5分钟后达到平衡,各物质的平衡浓度的关系为:[c(A)]a·c(B)=c(C) ·c(D)。此时若在温度不变的情况下将容器扩大为原来的10倍,A的转化率不发生变化,则B的转化率为:
A.60% B. 40% C. 240% D. 4%
11、c(NH4+)相同的下列溶液:①氯化铵 ②硫酸铵 ③硫酸氢铵 ④碳酸氢铵,其物质的量浓度由大到小的顺序是:
A. ②③①④ B. ②④①③ C. ①④③② D. ④①③②
12、一定温度下,在 一个体积可变的密闭容器中加入2molN2和2molH2,建立如下平衡:
![]() N2(g)+3H2(g) 2NH3(g),在相同的条件下,若向容器中再通入1molN2和1molH2,又达到平衡,则下列说法正确的是:
N2(g)+3H2(g) 2NH3(g),在相同的条件下,若向容器中再通入1molN2和1molH2,又达到平衡,则下列说法正确的是:
A. NH3的百分含量不变 B.N2的体积分数增大
C.H2的转化率增大 D. NH3的百分含量增大
13、在铁和铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1g,再向其中加入一定量稀硫酸,充分反应后,剩余金属m2g,则m1与 m2的关系是:
A. m1可能大于m2 B. m1一定等于m2 C. m1一定小于m2 D. m1一定大于m2
14、将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是:
A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
15、在含有FeCl3和BaCl2的酸性混合液中,通入足量SO2气体,有白色沉淀生成;过滤后,向滤液中滴加KSCN溶液,不出现红色,由此得出的结论是:
A.白色沉淀是BaSO3 B.白色沉淀是BaSO4和BaSO3
C.白色沉淀是BaSO3和S D.FeCl3被还原为FeCl2
16、有二元酸(简写为H2R)溶液,按下式发生电离:
![]()
![]() H2R
H+ +HR- HR- H++R2-
H2R
H+ +HR- HR- H++R2-
设有下列四种溶液:①0.01mol/L 的H2R溶液 ②0.01mol/L 的NaHR溶液③0.02mol/L HCl溶液与0.04mol/LNa2R溶液的等体积混合液 ④0.02mol/L的NaOH溶液和0.02mol/L的NaHR溶液的等体积混合液。下列说法正确的是:
A.c(H+)最大的是① ,最小的是② B.pH值最大的是①最小的是④
C.c(R2-)最大的是④ 最小的是① D.c(HR-)最大的是③最小的是①或④
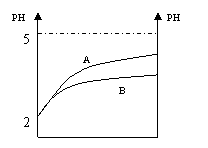 17、常温下,pH=2的两种溶液HA和HB,分别加水
17、常温下,pH=2的两种溶液HA和HB,分别加水
稀释1000倍,其pH与所加水的体积变化如图所示,
则下列说法正确的是:
A.酸HB是比酸HA更强的酸
B.酸HA是强酸,HB是弱酸
C.稀释前酸HA的物质的量浓度比HB大
D.稀释前酸HB比HA的物质的量浓度大
18、下列的说法不正确的是:
A. PH=7的溶液不一定是中性溶液
B.pH=11的氨水和氢氧化钠加水稀释1000倍,其pH值氨水大于氢氧化钠
C.100℃时,2LpH=8的Ba(OH)2的溶液与9LpH=5的稀硫酸溶液混合, pH近似为7
D. 亚硫酸钠溶液在空气中蒸干得到的固体是Na2SO3
19、将 5.1g镁铝合金投入到500mL2mol/LHCl中,金属完全溶解,再加入4mol/LNaOH溶液,若要生成的沉淀最多,则应加入的这种NaOH溶液的体积是:
A.200mL B. 250mL C. 425mL D. 560mL
20、某铁的氧化物,用7mol/L的盐酸100mL在一定条件下恰好完全反应,所得溶液中再通入0.56L标准状况下的氯气时,刚好使溶液中Fe2+完全转化为Fe3+,则该氧化物的化学式表示为:
A.FeO B.Fe3O4 C.Fe4O5 D.Fe5O7
二、填空题
21、(3分)某校自产的“××”牌矿泉水,富含锶元素,锶在生物体中是痕量元素(即每日需求量低于0.04g)。根据周期表,请回答下列问题:
(1)请指出锶在元素周期表中的位置: 。(2)氢氧化锶是强碱还是弱碱: 。
(3)请用最简便的方法证明氢氧化锶是强碱还是弱碱: 。
22、(14分)下列图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子。


(1)化学式:B为 ,F为 。
(2)用电子式表示D的形成过程为: 。
(3)已知H的密度比空气大,则①中所涉及的反应的化学方程式为:
; 。
(4)写出F与足量Y反应生成J的理由: 。
(5)写出A与D溶液反应生成B的离子方程式: 。
写出A在一定条件下与水反应的化学方程式: 。
23、(4分)甲、乙两瓶溶液,可能是AlCl3和NaOH。向10mL0.2 mol/L甲溶液中滴加未知的乙溶液,测得滴加15mL与45mL时,所得沉淀得质量相等。请回答:
(1)甲溶液为: ,乙溶液为:
(2)滴加45mL乙溶液的过程中发生的离子方程式为: 。
![]()
 (3)乙溶液的物质的量浓度为:
。
(3)乙溶液的物质的量浓度为:
。
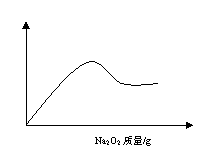
24、(3分)某溶液A可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、CO32-、SO42-等离子中的几种,取部分A溶液,加盐酸酸化后再滴入氯化钡溶液,只出现白色沉淀;另取部分A溶液,加入固体Na2O2有无色、无味的气体产生,并有白色沉淀生成,沉淀的量与所加Na2O2的关系如图所示,据此判断,溶液中一定含有 离子,一定不存在 离子,可能含有 。
三、实验题
25、(8分)某光卤石(KCl·MgCl2·6H2O)样品中含有不跟NaOH溶液、盐酸反应的杂质。某校化学课外活动研究小组现测定此样品中含有KCl·MgCl2·6H2O的质量分数,经讨论有多种实验测定方案。请根据提供的实验试剂和仪器(所需要的仪器任选),选择精确度较高的实验测定方案,简要写出第二步以后的实验步骤和实验结果。
(1)可选用的实验试剂:
①amol/LNaOH溶液②bmol/LNa2CO3溶液③cmol/LHCl溶液④dmol/LAgNO3溶液⑤酚酞溶液⑥紫色石蕊试液
(2)实验步骤:第一步:称取mg样品,放入250mL容量瓶中,加适量水溶解。
 第二步: ;第三步: ;第四步:
。
第二步: ;第三步: ;第四步:
。
(3)计算样品中含有KCl·MgCl2·6H2O(相对分子质量277.5)的在 质量分数表达式: 。(如果用以上试剂,其体积可分别用AmL、BmL、CmL、DmL表示)
26、(6分)用下面改进的方法可以制得白色的Fe(OH)2沉淀。在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
华中师大一附中2005—2006学年度第一学期
高二年级期末检测化学试题答题卡
一、选择题(3′×20=60′)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二、填空题(25′)
21、(4′)(1) 周期 族 (2) (各1分)
(3)
。(2分)
22、(14′) (1)化学式:B为 ,F为 。(各1分,其余各2分)
(2)用电子式表示D的形成过程为: 。
(3)已知H的密度比空气大,则①中所涉及的反应的化学方程式为:
; 。
(4)写出F与足量Y反应生成J的理由:
(5)写出A与D溶液反应生成B的离子方程式: 。
写出A在一定条件下与水反应的化学方程式: 。
23、(4′)(1)甲溶液为: ,乙溶液为: 。
(2)滴加45mL乙溶液的过程中发生的离子方程式为: 。
(3)乙溶液的物质的量浓度为: 。
24、(3′)溶液中一定含有 离子,一定不存在 离子,
可能含有 。
三、实验题(14′)
25、(8′)第二步: ;
第三步: ;
第四步: 。
(3)样品中含有KCl·MgCl2·6H2O(相对分子质量277.5)的 质量分数表达式:
。
26、(6分)(1)在试管Ⅰ里加入的试剂是 。(1分)
(2)在试管Ⅱ里加入的试剂是 。(1分)
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
四、计算题(11分)
27.环保化学中,COD(Chemical Oxygen Demand)是度量水中还原性污染物的重要指标。测定COD方法是:用强氧化剂(如KMnO4、NaClO等)处理1 L水样,当水中还原性污染物恰好被完全氧化时,测出消耗的氧化剂的量。然后将此氧化剂的量通过电子得失关系,换算成以O2作氧化剂时所需的O2的质量(a mg),该水样的COD即为a mg·L-1。现有某废水样品50.00 mL,加入0.0200 mol·L-1 KMnO4溶液10.00 mL,并加入适量硫酸和催化剂,放入沸水浴中加热一段时间,充分反应后,MnO4-被还原为Mn2+。用0.0200 mol·L-1 Na2C2O4标准液滴定多余的KMnO4,消耗Na2C2O4溶液5.00 mL。求该废水样品的COD。
(2KMnO4+5Na2C2O4+8H2SO4=K2SO4+5Na2SO4+10CO2↑+2MnSO4+8H2O)
28.2.80g铁与100mL稀硝酸混和后充分反应,产生的气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL 0.2 mol·L-1的碘化钾溶液,恰好将溶液中的Fe3+全部还原,求原硝酸溶液的物质的量浓度。
高二年级期末检测化学试题参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | C | D | C | B | C | A | B | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | A | D | A | D | D | D | D | B | D |
21.(1)五周期IIA族(2)强碱
(3)取氯化锶溶液,用pH试纸测定溶液的酸碱性,显示中性,证明是强碱。
22.(1)B:H2 F:FeCl2
(2)![]()
![]()
(3)2Na2O2+2H2O=4NaOH+O2↑ FeCl3+3NaOH=Fe(OH)3↓+3NaCl
(4) Na2O2具有氧化性,且与水反应生成碱,故Fe2+在此条件下可被氧化生成Fe(OH)3
(5)Fe+2H+=Fe2++H2↑ 3Fe+4H2O===Fe3O4+4H2↑(高温)
23.(1)AlCl3 NaOH
(2)Al3+ +3OH- =Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
(3)0.16mol·L-1
24.SO42- Al3+ Mg2+;CO32- Fe3+ NH4+;Na+
25.第二步:加入AmLamol/LNaOH溶液(过量),充分反应
第三步:直接在反应后的溶液中滴加酚酞指示剂2~3滴
第四步:用cmol/LHCl溶液滴定至由浅红色 至无色,消耗HCl溶液CmL
KCl·MgCl2·6H2O% 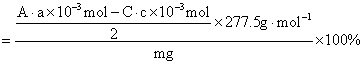
26.(1)稀 H2SO4 铁屑(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。
27.128mg/L
28.1.6 mol·L-1 n(Fe)=2.8g/56g·mol-1=0.05mol n[Fe(NO3)3]=n(I-)=0.1L×0.2 mol·L-1=0.02mol
故n[Fe(NO3)2]=n(Fe)-n[Fe(NO3)3]=0.05mol-0.02mol=0.03mol
由得失电子守恒:3n[Fe(NO3)3]+2n[Fe(NO3)2]=n(NO)×3
3×0.02mol+2×0.03mol=n(NO)×3 n(NO)=0.04mol
由氮原子守恒:n(HNO3)= n(NO)+ 3n[Fe(NO3)3]+ 2n[Fe(NO3)2]=0.16mol
c(HNO3)= 0.16mol/0.1L=1.6 mol·L-1