高二年级化学第二学期期中考试相关试卷
(时间:90分钟 满分100分) 2008年4月
相对原子质量: H—1 O—16 K—39 Cl—35.5 Ba—137 N—14 C-12
一.选择题(每小题只有一个正确选项)
1.通过核裂变产生核能可以用于发电,![]() 是一种常用的核燃料,下列说法错误的( )
是一种常用的核燃料,下列说法错误的( )
A ![]() 中中子数比质子数多51 B
中中子数比质子数多51 B ![]() 与
与![]() 属于同一种元素
属于同一种元素
C.![]() 与
与![]() 的质量比约为235:12 D.U元素的近似相对原子质量为235
的质量比约为235:12 D.U元素的近似相对原子质量为235
2.随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60,N5+等已被发现。下列有关说法中,正确的是( )
A.H2与H3属于同素异形体 B.O2与O4属于同位素
C.C60的摩尔质量为720 D.N5+离子中含有36个电子
3.下列物质中微粒的个数比不是1 : 1的是 ( )
A.NaCl晶体中的阴离子和阳离子 B.Na2O2固体中的阴离子和阳离子
C.重氢(![]() H)原子中的质子和中子
D.NH3分子中的质子和电子
H)原子中的质子和中子
D.NH3分子中的质子和电子
4.已知硅在自然界中有3种同位素,![]() ,
,![]() ,
,![]() .硅的近似相对原子质量为28.1,下列关于
.硅的近似相对原子质量为28.1,下列关于![]() 原子的百分含量的说法,正确的是( )
原子的百分含量的说法,正确的是( )
A.大于90% B.小于90% C.等于90% D.无法判断
5.下列原子中,最外层未成对电子数最多的是( )
A 核电荷数是5的原子核 B核电荷数是6的原子
C 核电荷数是12的原子 D核电荷数是15的原子
6.下列表达方式错误的是 ( )
A 甲烷的电子式 ![]() B 氟化钠的电子式
B 氟化钠的电子式 ![]()
C 硫离子的核外电子排布式 1s22s22p63s23p4 D 碳-12原子 ![]() C
C
7.下列是主族元素原子的最外层电子排布,其中化合价最高的是 ( )
A.nsnnpn+3 B. nsnnpn+1 C. nsnnpn+2 D.nsnnpn
8.下列各组的比较中错误的是 ( )
A.酸性:H3PO4<H2SO4<HClO4 B.碱性:Be(OH)2<Mg(OH)2<KOH
C.稳定性:PH3>H2S>NH3 F.半径:Cl->Mg2+>Al3+
9.下列含有非极性键的共价化合物是( )
A.HCl B.NaOH C.C2H2 D.CH4
10.下列物质中,化学式能准确表示物质分子组成的是( )
A.氯化铵(NH4Cl) B.白磷(P4) C.二氧化硅(SiO2) D.硫酸钠(Na2SO4)
11.下列含有极性键的非极性分子是( )
⑴HCl ⑵NH3 ⑶CH4 ⑷CO2 ⑸H2O ⑹苯 ⑺乙烯 ⑻乙炔
A、⑵⑶⑷⑸⑻ B、⑴⑶⑷⑸⑻ C、⑶⑷⑹⑺⑻ D、以上均不对
12.下列晶体熔化时,化学键没有被破坏的是 ( )
(A) 冰醋酸 (B) 氯化钠 (C) 金属钠 (D) 二氧化硅
13.下列有关说法正确的是 ( )
A 两种元素组成的分子中一定只有极性键
B 晶体中分子间作用力越大,分子越稳定
C 原子晶体中共价键越强,熔点越高
D. 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
14.下列物质性质的变化规律与分子间作用力有关的是 ( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
15.以下决定物质性质的因素全面、正确的是 ( )
A.元素的化学性质:元素原子的最外层电子数 B.KNO3的溶解度:温度
C.分子间作用力:相对分子质量 D.气体摩尔体积:温度、压强
16.某温度时,将烧杯中的x gKNO3饱和溶液恒温下蒸发部分溶剂,然后再将烧杯中的物质逐渐升温(假设升温时溶剂没有损失),能够正确表示此过程中KNO3溶液溶质的质量分数(w)与时间(t)关系的示意图是( )

17.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:
Cu2++SO42-+5H2O![]() CuSO4·5H2O,当向溶液中加少量无水硫酸铜粉末后,温度保持不变,
下列说法中正确的是( )
CuSO4·5H2O,当向溶液中加少量无水硫酸铜粉末后,温度保持不变,
下列说法中正确的是( )
A.溶液中Cu2+浓度增大 B.溶液中Cu2+数目不变
C.该硫酸铜晶体体积增大 D.溶液的蓝色变浅
18.下列实验方案能达到目的的是( )
A.除去CO2中混有的HCl和水蒸气: 通过盛有碱石灰的干燥管
B.实验室获取少量纯净的水:蒸馏自来水
C.提纯混有少量硝酸钾的氯化钠:将混合物溶于热水中形成浓溶液,再冷却、结晶并过滤
D.提取碘水中的碘:加入适量乙醇,振荡、静置、分液
19. 反应E+F →G在温度T1下进行,反应M+N→K在温度T2下进行,已知T1> T2;且E和F的浓度均大于M和N的浓度(其它条件均相同),则两者的反应速率( )
A.前者大 B.后者大 C. 一样大 D.无法判断
20.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A. 加热 B. 不用稀硫酸,改用98%浓硫酸,
C. 滴加少量CuSO4溶液 D.不用铁片,改用铁粉.
21.设 C(固)+CO2![]() 2CO- Q1 反应速度为V1;
2CO- Q1 反应速度为V1;
N2 + 3H2![]() 2NH3+Q2 反应速度为V2,
2NH3+Q2 反应速度为V2,
对于上述反应,当压强减小时,V1和V2的变化情况为 ( )
A.同时增大 B.同时减小 C.V1增大,V2减小 D.V1减小,V2增大
22. 在恒温下的体积固定的密闭容器中, 有可逆反应: A(s)+2B(g) ![]() C(g)+D(g)
C(g)+D(g)
下列各项中不能说明该可逆反应已经达到平衡的是( )
A.容器内气体的密度不随时间变化而变化
B. 2v正(B)=v逆(C)
C.混合气体的平均分子量不随时间变化而变化
D. A的质量百分数不随时间变化而变化
23.对于密闭容器中进行的反应,CO(g)+H2O(g)
![]() CO2(g)+H2(g)+Q,
CO2(g)+H2(g)+Q,
改变下列条件,平衡一定正向移动的是( )
A.增大压强 B.通入CO2 C.降温 D.加入催化剂
24.下列事实中,不能用勒夏特列原理解释的是( )
A.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
B.由H2(g)、I2(g)、HI(g)组成的平衡体系,加压后颜色加深
C.实验室常用排饱和食盐水的方法收集氯气
D.及时分离从合成塔中出来的混合气,有利于合成氨
25.对于密闭容器中的反应:N2(g )+3H2(g)![]() 2NH3(g)+Q. 673K、30Mpa下
2NH3(g)+Q. 673K、30Mpa下
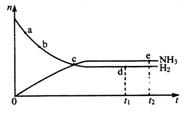 n(NH3)和n(H2) 随时间变化的关系如图所示。
n(NH3)和n(H2) 随时间变化的关系如图所示。
下列叙述正确的是( )
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d (t1时刻)和点e (t2时刻)处n (N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小
二.填空、简答题
26.现有部分短周期主族元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 原子M层上有2对成对电子 |
| B | 元素最高正价是+7价 |
| C | 原子核外p电子数与s电子数相等,且具有四种不同能量的电子 |
| D | 原子3p亚层上有一个未成对电子,常温下单质呈固态 |
① 用元素符号将B、D两元素填写在下面元素周期表中对应位置。
② 元素A的原子最外层共有 种不同运动状态的电子。
③ 元素B的阴离子的电子式为___________ 其气态氢化物的电子式为_________
④ 在元素C的单质、元素D的单质和元素C、D形成的合金这三种物质中,熔点最高的的是_______________ 。(填物质名称)
⑤ A元素与B元素相比较,非金属性较强的是 (填名称),
下列表述中不能证明这一事实的是( )
a. 在溶液中B的单质能置换出A的单质
b. B的气态氢化物比A的气态氢化物稳定
c. B的气态氢化物的沸点比A的气态氢化物高
d. 在B与A形成的共价化合物分子中共用电子对偏向B原子
⑥ 某同学猜想D和B形成的化合物晶体类型与NaCl相同,则其熔沸点应 (填“高于”或“低于”)NaCl。
如果用实验证明上述猜想不正确,你的实验方案是:
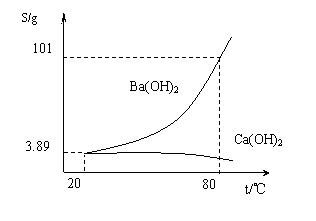
27.实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
(1)高温灼烧碳酸钡和碳酸钙的混合物,直至完全分解。
(2)将灼烧后的固体混合物置于80 ℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 。
此操作所需的玻璃仪器有_______________________________________________。
(3)将“(2)”中滤液 并过滤,得到的Ba(OH)2固体。分析上图可知:
80 ℃时Ba(OH)2的饱和溶液828克冷却到20 ℃,可析出Ba(OH)2(不含结晶水)
_________________克。(答案取整数)
(4)将(3)得到的Ba(OH)2固体溶于水制成溶液,滴加酚酞试剂,再通入二氧化碳,当观察到 时,即可停止通二氧化碳。
(5) 经过滤、_________、 后即得到纯净的碳酸钡。
28.影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
实验一:甲同学利用Al、Fe、Mg和2 mol/L硫酸,设计实验方案研究影响反应速率的因素。
(1) 甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Al、Fe、Mg。 | 反应快慢: Mg> Al> Fe | 反应物的性质越活泼,反应速率越快。 |
该同学实验的目的是________________________________________________________;
要得出正确的实验结论,还需控制的实验条件是___ _____ 。
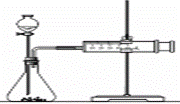
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置在同温下进行定量实验。用大小、形状相同的Fe分别和0.5mol/L及2mol/L的足量稀硫酸反应。
通过 可以说明浓度对反应速率的影响
实验二:已知2KMnO4+5H2C2O4+3H2SO4 → K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(3) 针对上述实验现象,某同学认为该反应放热,导致溶液温度升高,反应速率加快。 从影响化学反应速率的因素看,你的猜想还可能是_______ 的影响。
(4) 若要用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还可以在反应已开始时加入 ( )
A、硫酸钾 B、硫酸锰 C、水
29.在一容积为2升的密闭容器内加入0.2 mol的N2和0.6 mol 的H2,
在一定条件下发生如下反应: N2 + 3H2 ![]() 2NH3(g )+ Q
2NH3(g )+ Q
反应中NH3的物质的量浓度的变化的情况如下图:
浓度(mol/L)
 |
(1) 在图上作出0到5分钟内H2的浓度变化曲线
(2) 根据上图数据,反应开始至达到平衡时,平均速率υ(N2)为_________ mol/(L·min)。
(3) 反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (填序号) 。
A、0.20 mol/L B、0.16 mol/L
C、0.10 mol/L D、0.05 mol/L
(4)反应达到平衡后,第5分钟时,保持其它条件不变,若只把容器的体积缩小一半,
平衡 移动(填“向左”、“向右”或“不”),
下列有关说法正确的是
a 氢气的浓度减少 b 正反应速率减小,逆反应速率加快
c 容器中气体的密度将增大 d 重新平衡时与原平衡相比n(H2)/n(NH3)减小
若在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟到此平衡时NH3浓度的变化曲线。
三.计算题
30.t℃时,甲、乙两个烧杯中各盛有200g 相同浓度的硝酸钾溶液。现将甲烧杯中的溶液蒸发掉20g 水,恢复到t℃时析出KNO3固体8g ;乙烧杯中的溶液蒸发掉40g水,恢复到t℃时析出KNO3固体20g。
(1)乙烧杯中剩余KNO3溶液的物质的量浓度_______甲烧杯中剩余KNO3溶液
物质的量浓度 (填大于、小于、等于或无法确定)
(2)t![]() 时 KNO3的溶解度为_________________g/100g水
时 KNO3的溶解度为_________________g/100g水
(3) 求原溶液中溶质的质量分数(要求计算过程)

高二年级化学相关答题卷
一. 单项选择题
| 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
| 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
| 11 | 12 | 13 | 14 | 15 |
|
|
|
|
|
|
| 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
| 21 | 22 | 23 | 24 | 25 |
|
|
二.填空、简答题
26.
① 用元素符号将B、D两元素填写在下面元素周期表中对应位置。
② ___________种
③ _____________________, ________________
④ _____________,
⑤ ________________, ( )
⑥ ___________,
_______________________________________________________________________
27. ⑵ _________________, __________________________________________________
⑶ _____________________ , _________________克
⑷______________________________________________________________________ ;
⑸_______________,_______________
28.
(1) _______________________________________________________________________ ,
_____________________________
(2) ________________________________________________________________________
(3) __________________________________________
(4) _________
29.
 (1)
(1)
(2) __________________ mol/(L·min); (3) ________________
(4) _________________ , ___________________
请在上图中画出第5分钟到此平衡时NH3浓度的变化曲线。
三.计算题
30. (1) _______________ (2)__________________ g/100g水
(3)
第二学期期中考试
高二年级化学相关参考答案
一. 单项选择题(每小题2分)
| 1 | 2 | 3 | 4 | 5 |
| D | A | B | A | D |
| 6 | 7 | 8 | 9 | 10 |
| C | B | C | C | B |
| 11 | 12 | 13 | 14 | 15 |
| C | A | C | D | D |
| 16 | 17 | 18 | 19 | 20 |
| A | C | B | D | B |
| 21 | 22 | 23 | 24 | 25 |
| B | B | C | B | A |
二.填空、简答题
26.
① 用元素符号将B、D两元素填写在下面元素周期表中对应位置。(2分)
| Al | Cl | ||||||||||||||||
![]() ② ____6_____种 (1分)
② ____6_____种 (1分)
③ , , ![]() (各1分)
(各1分)
④ ____铝______, (1分)
⑤ ___氯___,(1分) ( C ) (2分)
⑥ ____高_______,(1分)
测熔融状态下该化合物的导电性,不能导电。 (2分)
27. ⑵ 趁热过滤(1分)(不写 趁热不给分) 玻璃棒、漏斗、烧杯 (各1分)
⑶ 冷却结晶 , (1分) 400克(2分)
⑷ 红色刚好褪去时 ; (1分)
⑸ 洗涤, 烘干(各1分)
28.
(1) 比较反应物本身的性质对反应速率的影响 , (2分)
温度相同(2分)
(2) 测定比较产生相同体积氢气所需的时间(合理答案即可) (2分)
(3)Mn2+的催化作用(或催化剂)(2分)
(4)(B)(2分)
29.
 (1) (2分)
(1) (2分)
(2) 0.0125 mol/(L·min); (2分) (3) ____AC____________(2分)
(4) ______向右____ , (2分) ______cd______(2分)
请在上图中画出第5分钟到此平衡时NH3浓度的变化曲线。(2分)
三.计算题
30. (1) ____等于_____ (1分) (2)_____60______ g/100g水(2分)
(3) 36.25%(3分)
