高二年级(理)化学下学期测试试题
命题人:胡艺群 2008-3-20
注意: 答题应答在答案卷上,考试结束后只交答案卷。
可能用到的相对原子质量:H 1、C 12、N 14、O 16、Na 23、Ag 108、
第I卷(共60分)
一、选择题:(每题只有一个正确答案,每题3分,共60分)
1.据统计,世界上的古建筑在20世纪所遭受的腐蚀比过去几百年甚至几千年所遭受的腐蚀还要严重,这是因为( )
A.古建筑的腐蚀是可逆过程,在前几百年甚至几千年前处于化学平衡状态,而近几
十年来腐蚀向正反应方向移动
B.由于近几十年来大量使用化石燃料,造成酸雨,加速了古建筑的腐蚀
C.由于近几十年来参观的人数急剧增多,加速了古建筑的磨损
D.由于近几十年来温室效应加剧,加速了古建筑的风化
2.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.冷却熟石灰的悬浊液,悬浊液中固体含量减少
D.热的纯碱溶液去油污效果好
3.将冰醋酸加水溶解并稀释,下列说法一定正确的是( )
A.溶液中c(H+)和c(OH-)都减小 B.溶液的导电能力增强
C.醋酸的电离平衡向右移动 D.溶液的pH增大
4.今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说
法不正确的是( )
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a+b=0.2mol/L
5.对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.使温度都升高20℃后,两溶液的pH均不变
C.加水稀释2倍后,两溶液的pH均增大,且变化的倍数一样多
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
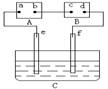 6.下图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为Pt电极。接通电源后,发现d点显红色。下列有关说法正确的是( )
6.下图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为Pt电极。接通电源后,发现d点显红色。下列有关说法正确的是( )
A.电源A上的a极是正极
B.d极上的电极反应方程式为2Cl--2e-=Cl2↑
C.e、f极上产生的气体体积比为2:1
D.C中溶液的pH增大
7.下列离子方程式正确的是( )
A.碳酸氢钠溶液与足量石灰水反应
2HCO3—+Ca2+ +2OH—== CaCO3↓+2H2O+CO32—
|
C.用惰性电极电解硝酸银溶液 4Ag++4OH—==4Ag+O2↑+2H2O
D.亚硝酸钠水溶液显碱性 NO2— +H2O![]() HNO2+OH—
HNO2+OH—
8.用酚酞作指示剂,以0.10 mol·L-1的NaOH溶液测定装在锥形瓶中的一定体积的盐酸溶液的物质的量浓度。下列操作将导致测定值高于实际值的是( )
A.标准液在“0”刻度线以上,未予调整就开始滴定
B.碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗
C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视
D.酚酞指示剂由无色变为红色时立即停止滴定
9.在一固定容积的密闭容器中,保持一定温度进行如下反应:
H2(g)+Br2(g) ![]() 2HBr(g),已知加入1mol
H2 和2mol Br2 达到平衡后,生成了a mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为 x mol、y mol、z mol、(均不为0)且保持平衡时,各组分含量都不变。以下推断中一定正确的是( )
2HBr(g),已知加入1mol
H2 和2mol Br2 达到平衡后,生成了a mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为 x mol、y mol、z mol、(均不为0)且保持平衡时,各组分含量都不变。以下推断中一定正确的是( )
A.x、y、z应满足的关系为:4x + z = 2y
B. 达到平衡时HBr 的物质的量为xa mol
C.达到平衡时HBr 的物质的量为a mol
D.x、y、z应满足的关系为:x + y = z
10.在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该条件的反应一定是( )
A pH=2的CH3COOH与pH=12的NaOH溶液等体积混合
B.0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液混合
C.CH3COOH溶液与NaOH溶液混合后所得溶液的pH=7
D.0.1 mol·L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合
11.某溶液既能与NaOH反应生成一种能使湿润的红色石蕊试纸变蓝色的气体,又能与FeCl3溶液反应生成淡黄色沉淀,则在该溶液中可以大量共存的离子组是( )
A.K+、Na+、CO32—、Cl— B.Na+、SO42—、Cl—、 ClO—
C.H+、Mg2+、SO42—、NO3— D.Ag+、K+、NO3—、Na+
12.已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO![]() 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.加入NaHSO4晶体抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
13、已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的( )
A、X的能量一定高于M
B、Y的能量一定高于N
C、X和Y的总能量一定高于M和N的总能量
D、因该反应为放热反应,故不必加热就可发生
14、下列说法正确的是( )
A、物质的溶解性为难溶,则该物质不溶于水
B、不溶于水的物质溶解度为0
C、绝对不溶解的物质是不存在的
D、某离子被沉淀完全是指该离子在溶液中的浓度为0
15.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是( )
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5
16、下列对化学平衡移动的分析中,不正确的是 ( )
![]() ①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
![]() ②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
17、今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g);ΔH=aKJ·mol-1,
H2(g)+1/2O2(g)=H2O(l);ΔH== bkJ·mol-1,
2H2(g)+O2(g)=2H2O(l);ΔH== ckJ·mol-1,
关于它们的下列表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.a== b D.2b== c
18.某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
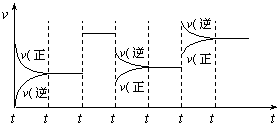 A.t2时加入了催化剂
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.t4~t5时间内转化率一定最低
19.为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是
A.甲同学:
在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
20.下列说法中正确的是 ( )
A.从平衡常数的大小可以推断任意反应进行的程度
B. K值越大,反应的转化率越小
C. K值越大,反应的转化率越大
D.温度越高,K值越大
第II卷(共40分)
21. I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
II.(1)现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是:
第一步,把小块pH试纸放在表面皿(或玻璃片)上,
第二步,
。
(2)该纯碱溶液呈碱性的原因(用离子方程式表示)是 ,
你认为该溶液pH的范围一定介于7至 之间。
(3)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
。
22烯烃通过臭氧化并经锌和水处理得到醛或酮,例如:
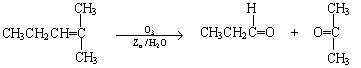 |
一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。其转化关系如下;
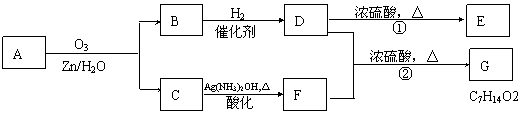
请回答下列问题:
(1) B的相对分子质量是______________。
(2) 写出结构简式:A__________________ 、E_______________________ 。
(3) 写出反应①、②的反应类型:①____________、②_______________。
(4) 写出反应②的化学方程式: 。
23.向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀。已知AgCl(s)的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10。(混合后溶液的体积变化忽略不计)。试计算:
(1)沉淀生成后溶液中Ag+的浓度
(2)沉淀生成后溶液的pH

答案卷(共40分)
21.I.
(1) 。
(2)
II.(1)
。
(2)
,
之间。
(3)
。
22
(1) ______________ 。
(2) A__________________ 、
E_______________________ 。
(3)①____________、②_______________。
(4) 。
23.
(1)
(2)
参考答案
1B 2B3C4A5A6C7D8B9A 10A11A12D13C14C15D16D17D18A 19A20C
21.I(1)吸氧
(2)2H2O+O2+4e-=4OH-II.
II(1)用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH
(2)CO32-+H2O![]() HCO3-+OH-;13
HCO3-+OH-;13
(3)向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去。说明纯碱溶液呈碱性是由CO32-引起的。
22(1)86
(2)A:(CH3CH2)2C=CHCH3 E:CH3CH=CHCH2CH3
(3)①消去反应 ②酯化(取代)反应(各2分)
(4)CH3COOH+CH3CH2CH(OH)CH2CH3![]() CH3COOCH(CH2CH3)2+H2O
CH3COOCH(CH2CH3)2+H2O
23、(1)c(Ag+)=1×10-7mol/L,(3分) (2)pH=2(3分)