2003-2004学年度上学期
高中学生学科素质训练
高二化学同步测试(12)— “几种重要的金属”
一、选择题(每小题只有一个选项符合题意,每小题2分,共20分)
1.下列制绿矾的方法最适宜的是用 ( )
A.![]() 与稀
与稀![]() B.
B.![]() 屑与稀
屑与稀![]()
C.![]() 与稀
与稀![]() D.
D.![]() 与
与![]() 粉
粉
2. 5.0g金属混合物与足量稀盐酸反应,收集到2.8L![]() (标准状况),这种混合物可能的组成是 ( )
(标准状况),这种混合物可能的组成是 ( )
A.![]() 和
和![]() B.
B.![]() 和
和![]() C.
C.![]() D.
D.![]()
3.向![]() 的
的![]() 溶液中加入足量的铜片并加热。充分反应后,被还原的
溶液中加入足量的铜片并加热。充分反应后,被还原的![]() 的物质的量是 ( )
的物质的量是 ( )
A.小于![]() B.等于
B.等于![]()
C在![]() 与
与![]() 之间 D.大于
之间 D.大于![]()
4.在![]() 的溶液中,能大量共存的无色离子组是 ( )
的溶液中,能大量共存的无色离子组是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
5.钢铁在锈蚀过程中,下列几种变化中可能发生的是 ( )
(1)![]() 由+2价转化为+3价 (2)
由+2价转化为+3价 (2)![]() 被还原 (3)产生
被还原 (3)产生![]()
(4)![]() 失水形成
失水形成![]() (5)杂质碳被氧化除去
(5)杂质碳被氧化除去
A.(1)(2)(3)(4) B.(1)(2)(4)(5)
C.(1)(3)(4)(5) D.(2)(3)(4)(5)
6.我国是世界上研究超导技术比较先进的国家,在高温超导材料中,铊(![]() )是重要成分之一,已知铊与铝是同主族元素。关于铊的性质推断可能错误的是( )
)是重要成分之一,已知铊与铝是同主族元素。关于铊的性质推断可能错误的是( )
A.铊是银白色,质软的金属 B.铊不能形成气态氢化物
C.铊与稀硝酸反应生成![]() D.
D.![]() 是两性氢氧化物
是两性氢氧化物
7.含有![]() 的溶液中加入下列试剂,不能得到
的溶液中加入下列试剂,不能得到![]() 的是 ( )
的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
8.欲除去含有![]() 和
和![]() 的混合溶液中的
的混合溶液中的![]() ,选用下列一种试剂(适量)即可,该试剂是 ( )
,选用下列一种试剂(适量)即可,该试剂是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
9. 将适量铁粉放入![]() 溶液中,完全反应后,溶液中
溶液中,完全反应后,溶液中![]() 和
和![]() 浓度相等,则已反应的
浓度相等,则已反应的![]() 与未反应的
与未反应的![]() 的物质的量之比是 ( )
的物质的量之比是 ( )
A.2:3 B.3:2 C.1:2 D.1:1
10.向含有![]() 的溶液中加入含
的溶液中加入含![]() 的溶液,生成沉淀的物质的量可能是
的溶液,生成沉淀的物质的量可能是
(1)![]() (2)
(2)![]() (3)
(3)![]() (4)
(4)![]() (5)
(5)![]() (6)
(6)![]() ( )
( )
A.(1)(2)(4)(5)(6) B.(1)(3)(4)(5)(6)
C.(1)(2)(3)(5)(6) D.只有(1)(3)(5)
二、选择题:(每小题有一个或两个选项符合题意。每小题3分,共42分)
11.下列化合物的无水固体只能用单质相互反应直接制取,而不能用水溶液反应后加热蒸发得到的是 ( )
A. ![]() B.
B.
![]() C.
C.
![]() D.
D.
![]()
12.在铁粉中加入稀硝酸,当反应完全后,尚残留少量铁粉,则溶液中含量较多的阳离子是
( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13.下列离子方程式书写不正确的是 ( )
A.将铁屑投入稀硝酸中![]()
B.小苏打溶液跟烧碱溶液混合![]()
C.将钠投入到硫酸铜溶液中![]()
D.溴化亚铁溶液中通入过量氯气![]()
14.有![]() 四种金属,可以用盐酸把它们分成两组
四种金属,可以用盐酸把它们分成两组![]() 和
和![]() 。如在
。如在![]()
的盐溶液中加入过量的![]() 溶液,可得到C离子的沉淀;这四种金属两两组成原电池
溶液,可得到C离子的沉淀;这四种金属两两组成原电池
时,![]() 都是正极。如果用
都是正极。如果用![]() 来表示四种金属的顺序,则下列顺序正确的是( )
来表示四种金属的顺序,则下列顺序正确的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
15.将![]() 铁粉加入
铁粉加入![]() 的
的![]() 溶液中,充分反应后,其结果是( )
溶液中,充分反应后,其结果是( )
A.铁有剩余
B.往反应后溶液中滴入![]() 溶液,显红色。
溶液,显红色。
C.![]() 物质的量之比为6:1
物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
16.在甲、乙两个质量相等的烧杯中,分别装有![]() 盐酸,再往甲、乙烧杯中分别加入
盐酸,再往甲、乙烧杯中分别加入![]() 铝和Yg镁,反应完全后,甲、乙两烧杯的质量仍然相等,则X与Y的关系是 ( )
铝和Yg镁,反应完全后,甲、乙两烧杯的质量仍然相等,则X与Y的关系是 ( )
A.X:Y=2:3 B.X:Y=3:4 C.X=Y![]() 7.2g D.X
7.2g D.X![]()
17.将铁粉、铜粉、氧化铜粉末的混合物与适量盐酸反应,反应后铁和铜的单质剩余时,溶液中含有的阳离子是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
18.有一块铝铁合金,将其溶解于足量盐酸中,再加入过量![]() 溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数是 ( )
溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数是 ( )
A.22.2% B.30% C.75.5% D.80.6%
19.铁棒与石墨棒用导线连接后,浸入![]() 的食盐溶液中,可能出现的现象是( )
的食盐溶液中,可能出现的现象是( )
A.铁棒附近产生![]() B.铁棒被腐蚀
B.铁棒被腐蚀
C.石墨棒上放出![]() D.石墨棒上放出
D.石墨棒上放出![]()
20.有固体![]() 存在的饱和水溶液中有如下平衡:
存在的饱和水溶液中有如下平衡:
![]()
![]()
![]() ,加入下列物质:(1)水(2)
,加入下列物质:(1)水(2)![]() 固体(3)
固体(3)![]() 固体(4)盐酸(5)
固体(4)盐酸(5)![]() 固体,能使
固体,能使![]() 固体减少的是 ( )
固体减少的是 ( )
A.(1)、(4) B.(2)、(3)
C.(1)、(4)、(5) D.(1)、(2)、(3)(4)
21.有![]() 四种金属,若两两混合,取混合物
四种金属,若两两混合,取混合物![]() 与足量稀硫酸反应产生标准状况下
与足量稀硫酸反应产生标准状况下![]() ,此混合物的可能组合的方式最多有 ( )
,此混合物的可能组合的方式最多有 ( )
A.2种 B.3种 C.4种 D.5种
22.14g![]() 和
和![]() 的合金和足量的浓硝酸反应。将产生的
的合金和足量的浓硝酸反应。将产生的![]() 气体和
气体和![]() (标准状况)氧气混合。通入水中恰好全被吸收,则合金中铜的质量是 ( )
(标准状况)氧气混合。通入水中恰好全被吸收,则合金中铜的质量是 ( )
A.1.6g B.3.2g C.6.4g D.9.6g、
23.![]() 的
的![]() 溶液里加金属钾,完全反应后,恰好只形成
溶液里加金属钾,完全反应后,恰好只形成![]() 和
和![]() 溶液,则加入钾的物质的量是 ( )
溶液,则加入钾的物质的量是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
24.按下列过程,最终能够实现的是 ( )
A.![]() 晶体
晶体
B.![]() 溶液
溶液
![]() 晶体
晶体
C.镀锌铁片![]()
D.![]() 溶液
溶液![]() 胆矾
胆矾
三、填空题:
25.(6分)等质量的铜、锌、铁三种金属混合物![]() 加入
加入![]() 和盐酸的混合液中,充分反应后:(1)若无固体剩余,则溶液中的阳离子一定有____________,可能有___________;(2)若剩余固体为
和盐酸的混合液中,充分反应后:(1)若无固体剩余,则溶液中的阳离子一定有____________,可能有___________;(2)若剩余固体为![]() ,则溶液中的阳离子一定有____________,可能有
,则溶液中的阳离子一定有____________,可能有
__________________,一定没有____________;(3)若剩余固体为![]() ,则溶液中的阳离子一定有____________,一定没有_____________。
,则溶液中的阳离子一定有____________,一定没有_____________。
26.(12分)在一定条件下用普通铁粉和水蒸气反应,可以得铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉、![]() 盐酸,其它试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
盐酸,其它试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
填写下列空白:
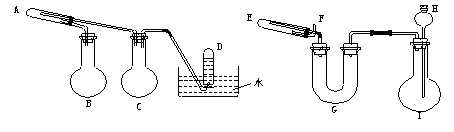
(1)实验进行时试管A中应加入的试剂是_______________;烧瓶B的作用是______________;烧瓶C的作用是_________________;在试管D中收集得到的是_____________。
(2)实验时,U型管G中应加入的试剂是______________;长颈漏斗H中应加入_____________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应字母)______________。
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是_____________。
(5)试管E中发生的化学方程式是___________________。
(6)为了安全,在E管中的反应发生前,在F出口处必须________________;E管中的反应开始后,在F中处应__________________。
27.(6分)A,B,C是中学化学中常见的单质。甲、乙两化合物在常温下分别为黑色晶体和无色液体。这些化合物和单质之间的关系如下图所示。据此推断:

(1)若元素A有可变化合价,则单质A的化学式为______________。甲的化学式:_____________________。
(2)根据金属活动顺序表判断单质A和单质C活动性强弱:A____________C(填>或<)。简述甲+C![]() 乙反应如何才能充分进行?____________________。
乙反应如何才能充分进行?____________________。
(3)甲还能与另一种常见金属在一定温度下发生反应,并放出大量热,写出该反应的化学方程式:__________________________。
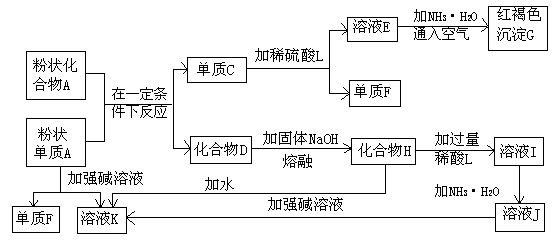
28.(6分)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
(1)单质F是_______________。
(2)写出由E生成G的离子反应方程式(或化学方程式)_________________________
___________________________。
(3)溶液I中所含金属离子是_____________________。
(4)由![]() 若改用浓酸,则不能选用的浓酸是(写分子式)。_____________。
若改用浓酸,则不能选用的浓酸是(写分子式)。_____________。
| |
四、 计算题:
29.(8分)在![]() 和
和![]() 的混合溶液中加入
的混合溶液中加入![]() 铁粉,充分反应后,滤出残留固体,洗涤、干燥后称量,其质量为16g,在滤液中加入
铁粉,充分反应后,滤出残留固体,洗涤、干燥后称量,其质量为16g,在滤液中加入![]() 溶液310mL,恰好使
溶液310mL,恰好使![]() 完全沉淀。求原混合液中
完全沉淀。求原混合液中![]() 和
和![]() 的物质的量浓度。
的物质的量浓度。
参考答案
一 单项选择题(2×10=20)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | D | A | D | A | D | C | C | A | B |
二. 多项选择题(3×14=42)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| AC | A | AD | B | BC | C | B |
| 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| B | B | C | C | B | D | BD |
三. 填空题
25. (1)![]()
(2)![]()
(3)![]()
26. (1)普通铁粉;B作为水蒸气发生器;C防止水倒吸;氢气
(2)碱性固体干燥剂;![]()
(3)A、B、E
(4)加快氢气产生的速率
(5)![]()
(6)检验![]() 的纯度;点燃
的纯度;点燃![]()
27. (1)![]() ;
;![]()
(2)<;该反应一定条件下为可逆反应,不断通入![]() ,导出水蒸气,使反应充分进行。
,导出水蒸气,使反应充分进行。
(3)![]()
28. (1)![]()
(2)![]()
或:![]()
![]()
(3)![]()
(4)![]() (或
(或![]() )
)
五. 29. ![]()
![]()