2003-2004学年度上学期
高中学生学科素质训练
高二化学同步测试(1)—氮和磷
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
1.通常情况下,氮气不易发生化学反应的原因是 ( )
A.N2是非极性分子 B.N2的分子量较小
C.N2分子由N≡N键结合而成,键能大 D.氮的非金属性比氧弱
2.下列反应起了氮的固定作用的是 ( )
A.氨经催化氧化生成NO
B.NO与O2反应生成NO2
C.N2在一定条件下与Mg反应生成Mg3N2
D.NH3与硝酸反应生成NH4NO3
3.下列反应中,起了氮的固定作用的是 ( )
A.N2和H2在一定条件下合成氨 B.由氨制成碳酸氢铵或硫酸铵
C.NO和O2反应生成NO2 D.NO2与H2O反应生成HNO3
4.在NO2被水吸收的反应中,发生还原反应和氧化反应的物质的质量之比为 ( )
A.3︰1 B.1︰3 C.1︰2 D.2︰1
5、金属机械加工后的废切削液中含2%—5%NaNO2,直接排放会造成环境污染,下述试剂中可能使其转化为N2的是 ( )
A.HNO3 B.(NH4)2SO4 C.Na3PO4 D.浓H2SO4
6.标准状况下,将NO2和O2按4︰1体积比充满一烧瓶,烧瓶倒置于水中待液面稳定(假设溶质不向外扩散),则烧瓶内溶液的物质的量浓度为(mol/L) ( )
A.1 B.0.8 C. ![]() D.
D.
![]()
7.采用不同的分类方法,可将非金属氧化物分为不同的类别。例如从某种意义上可将P2O5、SO2、SO3、CO2、Cl2O7等归为一类,则下列氧化物中与它们属于同一类的是 ( )
A.CO B.NO C.N2O5 D.NO2
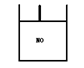 8.图为装有活塞的密闭容器,内盛22.4 mL 。若通入11.2 mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度 ( )
8.图为装有活塞的密闭容器,内盛22.4 mL 。若通入11.2 mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度 ( )
A.等于1.369g/L
B.等于2.054g/L
C.介于1.369g/L和2.054g/L之间
D.大于2.054g/L
9.Na3N是离子化合物,它与水作用可产生NH3,下列叙述正确的是 ( )
A.Na3N与盐酸反应可生成两种盐
B.在Na3N与水反应中,Na3N作还原剂
C.Na+与N3-的电子层结构都与氩结构相同
D.Na3N中Na+半径比N3-半径大
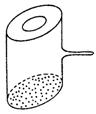 10.实验室里常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置
10.实验室里常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置
简单、操作方便、现象明显、可反复使用等优点。用此仪器不能
反复进行的实验是 ( )
A.NH4Cl受热分解的实验
B.KMnO4受热分解的实验
C.白磷和红磷在定温度下相互转变的实验
D.无水CuSO4与胆矾的互变实验
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选扣2
分,多选、错选均不给分)
11.下列各组气态氢化物中,按稳定性由弱到强的顺序排列正确的是 ( )
A.AsH3、PH3、H2S、HCl B.HF、HCl、HBr、HI
C.PH3、NH3、H2O、HF D.H2O、NH3、CH4、H2S
12.N2中混有少量CO2气体和水蒸气,除去的正确操作是 ( )
A.通过无水氯化钙的干燥管
B.通过浓硫酸的洗气瓶
C.先通过氢氧化钠溶液的洗气瓶,再通过浓硫酸的洗气瓶
D.先通过浓硫酸的洗气瓶,再通过氢氧化钠溶液的洗气瓶
13.室温时,将盛有20mL NO2和O2混合气体的量筒倒立在盛有水的水槽中,充分反应后,
量筒内残留气体3mL,则原混合气体中NO2的体积是 ( )
A.12.4mL B.13.6mL C.14.8mL D.17.8 mL
14.鉴别红棕色的溴蒸气和二氧化氮,可采用的方法是 ( )
A.通入淀粉碘化钾溶液中 B.通入硝酸银溶液
C.加水振荡 D.通入氯气
15.Murad等三位教授最早提出NO分子在人体内独特功能。近年来此领域研究有很大进展,因此这三位教授荣获1998年诺贝尔医学奖及生理学奖。下列关于NO的叙述不正确的是
( )
A.NO对环境的危害在于破坏臭氧层、形成酸雨等方面
B.NO可以是某些高价N物质的还原产物也可以是某些含低价N物质的氧化产物
C.实验室制取少量的NO可以用Cu和浓HNO3反应制取,且只能用排水取气法收集
D.生物体内存在少量NO能提高其生理机能,如扩张血管、促进免疫力
16.As2S3和As2O3的性质相似,均具有还原性;Na2S2和Na2O2的性质相似,均具有氧化性。当As2S3和Na2S2相互反应时,生成的可能是 ( )
A.NaAsS3 B.Na2AsS4 C.Na3AsS3 D.Na3AsS4
17.Bi是原子序数最大的氮族元素,推测Bi的化合物最不可能具有的性质是 ( )
A.BiH3很稳定 B.铋具有比铅更明显的非金属性
C.Bi(OH)3具有两性,但偏碱性 D.铋酸酸性比锑酸强
18.关于非金属元素N、O、Cl、P的叙述,正确的是 ( )
A.在通常情况下其单质均为气体 B.其单质均由双原子分子构成
C.都属于主族元素 D.每种元素仅生成一种氢化物
19.1999年曾报导合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是
( )
A.N5+共有34个核外电子 B.N5+中氮 氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1 D.化合物N5AsF6中F化合价为-1
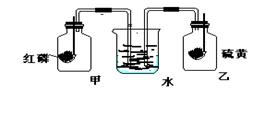 20.红磷和硫磺在两纯氧集气瓶中燃烧
20.红磷和硫磺在两纯氧集气瓶中燃烧
如图所示)当火焰熄灭时,观察到的现象是
A.水迅速进入甲瓶和乙瓶
B.水都不进入甲瓶和乙瓶
C.水只能进入甲瓶而不能进入乙瓶
D.水只能进入乙瓶而不进入甲瓶
21.CO2和NO共30mL,通过足量的Na2O2固体并充分反应后,气体体积缩小到20mL,
原混合气体中NO的体积为 ( )
A.10mL B.15mL C.20mL D.25mL
22.现有M、R两种第VA主族元素,下列事实不能说明M的非金属性比R强的事实( )
A.酸性.H3MO4﹥H3RO4 B.气态氢化物稳定性.MH3﹥RH3
C.气态氢化物的还原性.MH3﹥RH3 D.含氧酸盐的稳定性.Na3MO4﹥Na3RO4
三、填空题 (本题包括5小题,共35分)
23.(8分)Ca3(PO4)2 、CaHPO4 均为难溶于水的白色固体。某同学向Na2HPO4 溶液中滴加CaCl2 溶液至恰好反应,生成白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是Ca3(PO4)2 还是CaHPO4
| 实验原理._________________________________________________________ 实验用品及试剂.烧杯、玻璃棒、试管;石蕊试液、酚酞、PH试纸 |
| 实验步骤、现象、结论.(可不填满) 1、______________________________________________________________ 2、__________________________________________________________ 3、__________________________________________________________ 4、__________________________________________________________ |
24.(6分)有一句俗语叫“雷雨发庄稼”,其所包含的化学过程有(用化学方程式表示)
(1)__________________________________________
(2)__________________________________________
(3)__________________________________________
25.(10分)A.B.C.D是四种短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物E,1 mol该化合物含有42 mol电子,B原子的最外层电子数是次外层电子数的3倍,C元素是植物生长的营养元素之一,原子的最外层电子数是内层电子
数的一半;D原子核内没有中子
(1)A.B.C.D四种元素的名称及E的化学式为
A ________ B __________ C ___________ D._________ E.__________
(2)A.C元素气态氢化物的稳定性为______________﹤_____________
(3)用四种元素可组成三种盐,写出它们的化学式_____________、___________、___________
26.(3分)常见的大气污染分为一次污染和二次污染,二次污染物是排入环境中的一次污染物在物理化学因素或微生物作用下发生变化所生成的新污染物。如.2NO+O2=2NO2则NO2就是二次污染物,下列四种气体①SO2 ②NO ③NO2 ④Cl2中能导致二次污染
的是
27.(8分)我们用字母L、M、Q、P、R、X分别代表五种含不同化合价的氮元素的物质,并且每种物质中氮元素的化合价只有一种,又知道物质L中的氮元素的化合价要比物质M中氮元素的化合价低,并且在一定条件下,它们会有如下的相互转换关系(未配平)
Q + HCl → M +Cl2 R + L → X + H2O R + O2 → L + H2O
请判断.(1)已知这五种物质中有一种是硝酸,那么硝酸应该是L、M、Q、R、X中的_________(填字母),判断的依据是___________________________________
(2)反应③是在催化剂(如铂、氧化铁等)存在,并且加热到一定温度下反应,这个反
应在工业上有重要的作用,若物质X是密度比CO2小的气体,X的分子式是________
(3)某同学写出下面三个不同价态的氮的化合物相互转换的关系(未配平)、
A.NO+HNO3 → N2O3+H2O
B.NH3+NO → HNO2+H2O
C.N2O4+H2O → HNO3+HNO2
其中一定不可能实现的是____(填编号)
四、计算题(本题9分)
28.在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,
充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
参考答案
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | C | A | C | B | D | C | C | A | B |
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选扣2
分,多选、错选均不给分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| AC | C | BD | BC | C | D | AD | C | C | C |
| 21 | 22 | ||||||||
| C | CD |
三、填空题
23、(1)原理.若生成物的混合物显强酸性,则生成的沉淀为Ca3(PO4)2
2Na2HPO4 +3CaCl2 =Ca3(PO4)2 +4NaCl +2HCl
若生成物的混合物不显酸性,则生成的沉淀为CaHPO4
Na2HPO4+CaCl2=CaHPO4+2NaCl
(2)A.在Na2HPO4 溶液中滴加过量的氯化钙溶液
B.沉淀静置
![]() C.用玻棒沾取上层澄清液到pH试纸上,若溶液呈酸性,则证明生成的沉淀为Ca3(PO4)2
;反之则为CaHPO4
C.用玻棒沾取上层澄清液到pH试纸上,若溶液呈酸性,则证明生成的沉淀为Ca3(PO4)2
;反之则为CaHPO4
24、 ⑴ N2 + O2 2NO ⑵ 2NO + O2 = 2NO2 ⑶ 3NO2 + H2O = 2HNO3 )
25、(答案.⑴ 氮 氧 磷 氢 NH4NO3 ⑵ PH3 NH3 ⑶ (NH4)3PO4 (NH4)2HPO4
NH4H2PO4 )
26、( ①②③ )
27、(⑴Q 根据题给的关系,可以判断各物质中的氮元素的化合价高低顺序是R﹤X﹤L﹤M﹤Q,而HNO3中的N是氮元素的最高价态) ⑵ N2 ⑶ b
28、(9分)
(1)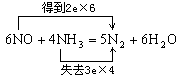 (方程式2分,电子转移1分) (3分)
(方程式2分,电子转移1分) (3分)
(2)6 mol
NO还原得到3 mol N2,4 mol NH3,氧化得到2 mol
N2,两者相差1 mol N2。现相差1.4g,![]() ,相当于0.3 mol NO和0.2
mol NH3反应。(3分)
,相当于0.3 mol NO和0.2
mol NH3反应。(3分)
依题意NO和NH3的总物质的量为1mol,其中必有一种为过量,所以有两种情况.
0.3 mol NO和0.7 mol NH3
0.2 mol NH3和 0.8 mol NO (对一组2分,两组都对3分) (3分)