第三节 硝酸( 第一课时)
一、单项选择题
( )1、下列金属中,在冷的浓硝酸中最难溶解的是
A.铜 B.银 C.铝 D.镁
( )2、铜与稀硝酸的反应中,如有1mol硝酸被还原,则被氧化的铜的物质的量为
A.3/8mol B.3mol C.3/2mol D.2/3mol
( )3、可用于鉴别浓硝酸和浓硫酸的试剂是
A.铜片 B.氧化铜 C.氢氧化铜 D.酚酞试液
( )4、往浅绿色的Fe(NO3)2,溶液中逐滴加入稀盐酸,溶液的颜色变化应该是
A.颜色变浅 B.变为绿色 C.没有改变 D.变棕黄色
( )5、碳和浓硝酸的反应中,氧化产物和还原产物是
A.C和NO B.CO2和NO2 C.NO2和CO2 D.H2O和NO2
二、不定项选择题
( )6、下列化学反应中,硝酸只表现了氧化性的是
A.3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
B.CuO+2 HNO3 (稀)=Cu(NO3) 2 +H2O
C.C+4HNO3 (浓)=CO2+4 NO2↑+2H2O
D.3Ag+4 HNO3 (稀)=3 Ag NO3 +NO↑ +2H2O
( )7、下列关于浓硫酸和浓硝酸的叙述正确的是
A.常温下都用铝制容器贮存
B.露置于空气中容器内酸液的质量都减轻
C.常温下都能与铜较快地反应
D.露置于空气中容器内酸液浓度前者增大后者减小
( )8、下列各组离子中,在溶液中可以大量共存的是
A.H+、Na+、SiO32—、SO42— B.NH4+、Na+、NO3—、Cl—
C.H+、Fe2+、NO3—、SO42— D.K+、Ba2+、OH—、Cl—
( )9、铜与1moL/L的硝酸反应,若NO3—浓度下降了0.2mol/L,则溶液中c (H+)同时下降
A.0.2mol/L B.0.4mol/L C.0.6mol/L D.0.8mol/L
( )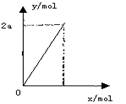 10、锌与不同浓度的硝酸可发生不同的反应(y表示耗去Zn的物质的量,x表示被还原硝酸的物质的量),其中参加反应的锌与被还原硝酸的物质
10、锌与不同浓度的硝酸可发生不同的反应(y表示耗去Zn的物质的量,x表示被还原硝酸的物质的量),其中参加反应的锌与被还原硝酸的物质
的量关系符合右图的是
A.3Zn+8 HNO3 (稀)==3Zn(NO3)2+4H2O+2NO↑
B.4Zn+10 HNO3 (稀)==4 Zn(NO3)2+5 H2O十N2O↑
C.4Zn+10 HNO3 (稀)==4 Zn(NO3)2+H2O+3NH4NO3
D.Zn+4 HNO3 (浓)==Zn(NO3)2+2 NO2↑+2H2O
三、填空题
11、纯净的硝酸是 色的液体,久置的硝酸呈黄色,原因是 ,硝酸必须盛放在 瓶中,贮放在 的地方。工业上溶解铜常用稀 酸,反应的离子方程式为 ,溶解金铂必须用 ,此溶液的成分是 的混合物,其体积之比是 。常用浓硝酸质量分数为69%, 密度为1.4g/cm3,其物质的量浓度为 。贮运浓硝酸常用 槽车。实验室制氢气常用稀硫酸或稀盐酸而不用硝酸,是因为 。
12、在NO、NO2、CO2、HCl、SO2中,可以用硝酸与其它物质反应制取的气体有
,写出有关的化学方式
。
四、计算题
13、某100mL混合液中HNO3和H2SO4的物质的量浓度分别是0.5moL/L和0.15mol/L,向该混合液中加入5.76g铜粉,加热,待充分反应后,
则求:(1)所得溶液中Cu2+的物质的量浓度(mol/L) 。
(2)若要使5.76g铜粉完全溶解,且溶液中只存在一种盐,则原溶液中的硝酸和硫酸的物质的量浓度分别是多少?
14、 1.92g铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成的气态颜色逐渐变浅,当铜片反应完毕时共收集到气体1.12L(标况)。
求:(1)反应消耗的HNO3的物质的量。
(2)生成的气体水洗后,剩余气体的体积是多少毫升?
第三节 硝酸 (第二课时)
一、单项选择题
( )1、19.2g铜与足量的稀硝酸反应,被还原的硝酸的物质的量是
A. 0.2 mol B.0.4 mol C.0.6 mol D.0.8 mol
( )2、在标准状况下,将NO2、NO、O2混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器(假设产物不扩散),则容器内HNO3溶液的物质的量浓度c (mol/L)为
A.1/28<c<1/22.4 B.1/39.2<c<1/22.4
C.1/39.2<c<1/28 D.0 < c < 1/22.4
( )3、在某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4的物质的量浓度为0.2mol/L。向其中加入2.56g铜粉、微热,待充分反应后,溶液后Cu2+的物质的量浓度约为
A.0.15 mol/L B.0.3 mol/L C.0.225 mol/L D.无法计算
( )4、38.4g铜与适量浓HNO3反应,铜全部作用后共收集到22.4L气体,则反应消耗HNO3的物质的量为
A.1mol B.1.6mol C.2.2mol D.2.4mol
5、某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
A.NO2 B.NO C.N2O D.N2
二、不单项选择题
6、用以下三种途径来制取相等质量的硝酸铜:
(1)铜跟浓硝酸反应,(2)铜跟稀硝酸反应(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述正确的是
A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗的铜的物质的量是途径(3)>途径(1)>途径(3)
D.所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
( )7、在铁和铜的混合物中,加入一定量的稀HN03,充分反应后剩余m1 g金属,再向其中加入一定量的稀硫酸,充分振荡后,剩余m2 g金属,则m1与m2之间的关系是
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
( )8、某单质跟浓硝酸反应时,每有0.25mol单质反应就消耗1mol硝酸,则该单质氧化后元素的化合价可能是
A.+1 B.+2 C.+3 D.+4
( )9、某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
A.N2O B.NO C.NO2 D.N2
( )10、3.2gCu与过量HNO3(8mol/L 30mL)充分反应,HN03的还原产物有NO2和NO,反应后溶液中所含H+ 为amol,则此时溶液中所含NO3—为
A.amol B.(0.24-a)mol C.(0.1+a)mol D.(0.14+a)mol
( )11、锌与稀硝酸反应中消耗锌与硝酸的质量比为26:63,生成唯一的还原产物,其可能是
A.N2O B.NO C.NO2 D.NH4NO3
( )12、工业制硝酸的尾气含NO2、NO,通常用NaOH溶液吸收:NO+ NO2 +2NaOH ==== 2NaNO2+H2O, 2NO2+2NaOH===== NaNO2+NaNO3+H2O,NO2与NO的体积比为下列值时,不能被完全吸收的是
A.1:1 B.2:1 C.3:1 D.1:2
三、计算题
13、100mL2mol/L的稀硝酸与1.92g铜充分反应后:
(1)产生的气体是 ,在标准状况下的体积为 L,反应过程中转移的电子数
是 mol。
(2)若溶液的体积不变,则反应后溶液中的H+物质的量浓度为 mol/L,NO3-物质的量浓度 mol/l。 (写出计算过程)
14、3.2g Cu与过量硝酸(amol·L-1,30mL)充分反应。硝酸的还原产物有NO2、NO。反应后溶液中含H+为0.1mol·L-1.
(1)此时溶液中所含NO3-为 mol.
(2)生成的气体中NO2、NO物质的量分别为多少?
15.为了测定某铜银合金的成分,将30g合金溶于80mL l3.5mol/L的浓硝酸中,待合金完全溶解后,收集到6.72L(标准状况)气体,并测得溶液中 [H]+==1 mol/L ,设反应后溶液体积仍为80mL。计算:(1)被还原的硝酸的物质的量;(2)合金中银的质量分数。
第三节 硝酸 (第三课时)
一、单项选择题
( )1.用铜锌合金制成的假金元宝骗人的事件屡有发生,下列不易区别其真伪的是
A.测定密度 B.放入硝酸中 C.放入盐酸中 D.观察外观
( )2.取三张蓝色石蕊试纸放在玻璃棒上,然后按顺序分别滴加69%HNO3,98.3%
H2SO4和新制氯水,三张试纸最后呈现的颜色依次为
A.白 红 白 B.红 黑 红 C.红 红 红 D.白 黑 白
( )3.把70%的HNO3(密度1.40g/cm3)加到等体积水中,稀释后硝酸溶液中溶质的质量分数
A.=0.35 B.<0.35 C.>0.35 D.≤0.35
( )4.实验室不需用棕色试剂瓶保存的试剂是
A.浓硝酸 B.硝酸银 C.氯水 D.浓硫酸
( )5.实验室可以利用NaNO3和浓H2SO4加热制取硝酸,这是利用了HNO3的
A.氧化性 B.强酸性 C.不稳定性 D.挥发性
二、不定项选择题
( )6.通常情况下,下列溶液中能溶解铁的是
A.稀硝酸 B.浓硝酸 C.浓盐酸 D.浓硫酸
( )7.下列盛放试剂的方法,错误的是
A.把硝酸放在棕色试剂瓶中,并放置在冷暗处
B.把硝酸银放在棕色试剂瓶中
C.把氢氧化钠溶液放在带橡皮塞的玻璃瓶中
D.把氢氟酸放在玻璃瓶中
( )8.下列对于硝酸的性质的认识:①不稳定,容易分解 ②常温下不与铁铝反应③稀硝酸与锌可发生置换反应 ④是一种氧化性酸 ⑤用于制造炸药、农药和化肥,其中不正确的是
A.①③ B.②③ C.③ D.③⑤
( )9.铜粉和稀硫酸加热不反应,但再加入化合物x之后,加热,溶液逐渐变蓝色,而且质量增加,还放出气体,则x可能是
A.NaCI B.KNO3 C.Na3PO4 D.MgSO4
( )10.关于硝酸的化学性质的叙述正确的是
A.浓、稀硝酸都能使蓝色石蕊试纸变红 B.浓、稀硝酸都能使铁、铝表面钝化
C.实验室可用硝酸盐与浓硫酸在高温下反应来制取硝酸
D.浓硝酸因分解放出NO2,又溶于硝酸溶液中而呈黄色
三、填空题
11、浓HNO3使金属铝钝化是因为具有 性;浓HNO3常显黄色是因为混有
杂质;不用浓HNO3和Zn反应制氢气是因为有 性;为了防止浓HNO3的分解必须把它盛在 瓶中,贮放在 地方;王水是 和 的混合物,其溶液的体积之比是 。
12.请写出8种单质的化学式,它们与HNO3作用必须符合下列要求:
(1)生成相应的硝酸盐: 、 ;
(2)生成最高价氧化物或含氧酸: 、 ;
(3)在常温下呈钝态: 、 ;
(4)不发生反应: 、 ;
13.用右下图中的简易装置可以进行气体的发生和收集。
(1) 实验前应如何检查该装置的气密性? 。
(2) 拔开试管a的橡皮塞,加入10mL6mol/L的稀硝酸和lg薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速率缓慢,逐渐加快。请写出在试管a中所发生的所有反应的化学方程式 。
(3) 从反应开始到反应结束,预期在试管a中可以观察到哪些现象?请依次写出。
。
(4) 在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出。试说明反应开始时,导管中水面先上升的原因。
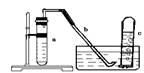
(5) 试管c收集满气体后,用拇指堵住管口将试管取
出水槽。将管口向上,松开拇指,此时可观察到什么
现象?
14.L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质。A、B分别代表两别含不同化合价的氯元素的物质(每种物质中,氮或氯元素的化合价只有一种),又知物质M中的氮元素的化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平):①P+A→Q+B ②L+O2→M+H2O ③L+M→R+H2O ④B+H2O→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是 ,理由是 。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途。据此推断在同温、同压下,若物质R的密度比二氧化碳的密度小,则R的化学式为 。
(3)某学生写出下面三个含氮的物质的相互转化的关系式:
(a)M+P→N2O3+H2O (b)N2O4+H2O→P+Q (c)M+L→Q+H2O
其中一定不可能实现的是 ,理由是 。
15.硝酸工业尾气中的氮的氧化物(NO、NO2)是要大气污染物,其常用的治理方法有以下两种(已简化):
①NaOH吸收法。反应原理是:2NO2+2NaOH NaNO3+NaNO2+H2O
NO+NO2+2NaOH
2NaNO2+H2O
②氨催化还原法。反应原理是NOx+NH3![]() N2+H2O 现有一定量的含NO2和NO的硝酸工业尾气(不含其他气体)若用过量NaOH溶液吸收后,溶液中NaNO3与NaNO2的物质的量之比恰好与尾气中NO和NO2的物质的量之比相等。
N2+H2O 现有一定量的含NO2和NO的硝酸工业尾气(不含其他气体)若用过量NaOH溶液吸收后,溶液中NaNO3与NaNO2的物质的量之比恰好与尾气中NO和NO2的物质的量之比相等。
(1)若用NOx表示氮的氧化物的平均组成,试求x的值。
(2)将1体积该尾气用氨催化还原法处理,至少消耗多少体积相同状况下的氨气?