第三节 第二课时
1、下列叙述错误的是 ( )
A.配制FeCl3溶液时,为了抑制水解,常加盐酸
B.盐类都能水解
C.盐类的水解反应通常是吸热反应
D.盐类水解是指盐的离子跟水电离出的H+和OH—生成弱电解质的反应
2、在相同温度下,等体积等物质的量的浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含带电微粒数由多到少的顺序是( )
A.①=④>③=② B.④=①>③>②
C.①>④>③>② D.④>①>③>②
3、将滴有甲基橙的醋酸钠饱和溶液加热,溶液的颜色是 ( )
A.黄色不变 B.黄色变橙色 C.黄色变红色 D.橙色不变
4、为了使Na2S溶液中C(Na+)/C(S2—)的比值变小,可加入的物质是 ( )
A.适量盐酸 B.适量NaOH溶液 C.适量KOH溶液 D.适量KHS溶液
5、下列物质的稀溶液中,溶质的阴、阳离子的个数比为1∶2的是 ( )
A.(NH4)2SO4 B.NaHSO4 C.K2S D.Na2SO4
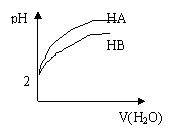 6、盛有0.1 mol/l NaHCO3溶液和酚酞试液的试管, 在室温时溶液为无色,加热时变成粉红色,这是因为 ( )
6、盛有0.1 mol/l NaHCO3溶液和酚酞试液的试管, 在室温时溶液为无色,加热时变成粉红色,这是因为 ( )
A.NaHCO3 在加热时变成碱性更强的Na2CO3
B.水份蒸发使NaHCO3 浓度加大
C.加热促进NaHCO3水解,碱性增强
D.NaHCO3在加热时变成红色
7、pH=2 的两弱酸HA、HB加水稀释后,溶液 pH随加水量的
变化曲线如图所示。则下列叙述正确的是 ( )
A.电离平衡常数HA > HB
B.等体积的HA 和HB与等浓度的NaOH反应,HA消耗的NaOH多
C.等体积的HA和HB 与等质量的Zn反应,HB反应速率大
D.若有等浓度的NaA、NaB,则碱性NaA>NaB
8、相同温度下,在水中分别加入下列物质,若用KW表示水的离子积,α表示水的电离度,能使α/KW值增大的是 ( )
A.NaHSO4 B.NaOH C.Na3PO4 D.NH4Cl
9、有三种一元酸HA、HB、HC的钠盐分别为NaA、NaB、NaC,它们的物质的量浓度相同时,溶液的PH依次为9,10,8.则这三种弱酸的酸性由强到弱的顺序是 ( )
A.HA>HB>HC B.HB>HA>HC
C.HC>HB>HA D.HC>HA>HB
10、CH3COOH与CH3COONa等物质的量混合配制成稀溶液,PH为4.7,下列说法错误的是 ( )
A.CH3COOH的电离作用大于CH3COONa的水解作用
B.CH3COONa的水解作用大于CH3COOH的电离作用
C.CH3COOH的存在抑制了CH3COONa的水解
D.CH3COONa的存在抑制了CH3COOH的电离
11、若纯水中水的电离度为![]() 1,pH=x的盐酸中水的电离度为
1,pH=x的盐酸中水的电离度为![]() 2,pH=y的氨水中水的电离度为
2,pH=y的氨水中水的电离度为![]() 3,两溶液等体积混合后溶液中水的电离度为
3,两溶液等体积混合后溶液中水的电离度为![]() 4,若x+y=14(其中x≤6,y≥8),则
4,若x+y=14(其中x≤6,y≥8),则![]() 1、
1、![]() 2、
2、![]() 3、
3、![]() 4从小到大的顺序是:____________________。
4从小到大的顺序是:____________________。
12、将位于同一周期的主族元素A和B的氯化物AClx和BCly配制成等物质的量浓度的溶液,测得AClx溶液的pH小于BCly溶液的pH。试判断A、B两元素原子序数的大小关系___ _。
13、pH=2的某酸HnA与pH=12某碱B(OH)m等体积混合后,溶液的pH=8。
(1)反应所生成正盐的化学式为__ __。
(2)该盐中______离子一定能水解,水解离子方程式为___ 。
![]() 14、某二元弱酸溶液按下式发生一级和二级电离H2A H++HA-、
14、某二元弱酸溶液按下式发生一级和二级电离H2A H++HA-、
![]() HA- H++A2-。
HA- H++A2-。
已知相同浓度时的电离程度,a(H2A)>a(HA-),设有下列四种溶液:
A.0.01 mol/L的H2A溶液
B.0.01mol/L的NaHA溶液
C.0.02mol/L的HCl与0.04 mol/L的NaHA溶液等体积混合液
D.0.02 mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此填写下列空白(填代号):
(1)C(H+)最大的是____ ,最小的是______ 。
(2)C(H2A)最大的是______ ,最小的是______ 。
(3)C(A2-)最大的是______ ,最小的是______ 。
15、向盛有少量Mg(OH)2悬浊液培养皿中加入适量的饱和氯化铵溶液,Mg(OH)2悬浊液变澄清。
同学甲认为:
![]() 实验⑴中存在Mg(OH)2的溶解、结晶平衡:Mg(OH)2(固) Mg2+ +2OH-。当加入NH4Cl时,由于NH4+水解使溶液呈酸性。从而使溶液中C(OH-)减小,促进Mg(OH)2溶解,使溶液澄清。
实验⑴中存在Mg(OH)2的溶解、结晶平衡:Mg(OH)2(固) Mg2+ +2OH-。当加入NH4Cl时,由于NH4+水解使溶液呈酸性。从而使溶液中C(OH-)减小,促进Mg(OH)2溶解,使溶液澄清。
同学乙认为:
实验⑴中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。
甲、乙同学的两种解释谁的更有道理?试设计实验证明你的结论。