第二节 第三课时
1、pH=3 的醋酸溶液用水稀释,体积变为原体积的2倍,溶液的pH接近于 A.1.5 B.3.1 C.3.5 D.2.7 ( )
2、定温时将pH=2的盐酸和醋酸分别稀释到pH=3时,所稀释时用水的体积前者与后者的关系是 ( )
A.大于 B.小于 C.等于 D.不能确定
3、5mL0.1mol/L Ba(OH)2溶液稀释至1000mL,所得溶液的pH为 ( )
A.2.4 B.3 C.11 D.12
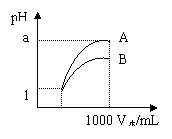 4、pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图,下列说法不正确的是
4、pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图,下列说法不正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
5、室温时,pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积
混合,恰好完全反应,则该醋酸的电离度可表示为 ( )
A.(1016-a-b)% B.(10a+b-14)% C.(10a+b-16)% D.(1014-a-b)%
6、取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是 ( )
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
7、pH值为6的硫酸稀释100倍,稀释后溶液中C(SO42- )和C(H+) 之比约为A.1/2 B.1/5 C.1/10 D. 1/20 ( )
8、重水(D2O)的离子积为1.6×10-15,用pH一样的定义来规定pD=—lgC(D+),以下关于pD的叙述正确的是 ( )
A.中性溶液的pD=7.0
B.含0.01mol的NaOD的D2O溶液1L,其pD=12.0
C.溶解0.01molDCl的D2O溶液1L,其pD=2.0
D.在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/L的NaOD的重水溶液,其pD=1.0
9、将1mol·L-1H2SO4溶液100mL与质量分数为10%的NaOH溶液50g混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是 ( )
A.浅紫色 B.黄色 C.红色 D.无色
10、将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为 ( )
A.9 B.10 C.11 D. 12
11、50mlPH=12的NaOH溶液与50mlPH=12的Ba(OH)2溶液相混合,混合液的PH为
12、现有下列两组溶液(Ⅰ)组:0.1mol/L的醋酸和盐酸,(Ⅱ)组:pH=11的氨水和氢氧化钠溶液。若将它们加水稀释相同的倍数,试比较(Ⅰ)组和(Ⅱ)组溶液pH值的大小:
(Ⅰ)组_______ _,(Ⅱ)组_________ 。
13、25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)___ ,其理由是__________ _ ;
(2)a值可否等于5(填“可”或“否”)_____,其理由是_______________;
(3)a的取值范围是_______________________________________
14、25℃时,有pH=x的盐酸和pH=y 的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问:
①若x+y=14,则a/b=____(填数据);
②若x+y=13,则a/b=____(填数据);
③若x+y>14,则a/b=____(填表达式);
④该盐酸与该氢氧化钠溶液按按体积比10∶1混合,恰好完全中和,两溶液的pH、x和y的关系式(填表达式): 。
 15、设水的电离平衡曲线如图所示
15、设水的电离平衡曲线如图所示
(1)若以A点表示水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 .
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸相混合,并保持100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2与盐酸的体积比为 .
16、c mol/L的AgNO3溶液中,加入一定量pH=1的盐酸时,恰好将Ag+完全沉淀,此时得到pH=2的溶液100mL。则c值应该接近何值(反应前后体积的变化忽略不计)?