第二节 第二课时
1、下列溶液一定显碱性的是 ( )
A.溶液中C(OH—)>C(H+) B.溶液的pH>7
C.滴加甲基橙后溶液显黄色 D.滴加甲基橙后溶液显红色
2、可以判断某酸(HA)是强电解质的现象是 ( )
A.该酸加热至沸腾也不分解 B. 该酸浓度为0.01mol·L-1时的值为2
C. 该酸可溶解氧化铜 D. 该酸可跟石灰石反应,放出CO2
|
A.大于 B.小于 C.等于 D.不能确定
4、下列四种溶液 ①pH=0的盐酸 ②0.1mol/L的盐酸 ③0.01mol/L的NaOH溶液 ④pH=11的NaOH溶液由水电离出的氢离子浓度之比为 ( )
A.1∶10∶100∶1000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
5、下列各种试纸,在使用时预先不能用蒸镏水润湿的是 ( )
A.红色石蕊试纸 B.蓝色石蕊试纸
C.碘化钾淀粉试纸 D.PH试纸
6、中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同物质的量浓度的盐酸的体积分别为V1、V2和V3,则三者关系为( )
A. V1>V2>V3 B. V3=V2>V1 C.V3>V2>V1 D. V1=V2<V3
7、下列说法正确的是 ( )
A.酸A和酸B溶液中C(H+) 分别为a、b ,a>b, 则B的酸性较弱
B.A溶液C(H+) = 1×10-6mol/L,则A溶液呈酸性
C.强酸溶液酸性比弱酸溶液强
D.A溶液的C(H+) = 1×10-7mol/L,则A溶液一定是水
8、为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念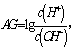 则下列叙述正确的是
( )
则下列叙述正确的是
( )
A.中性溶液的AG=0
B.酸性溶液的AG<0
C.常温下0.lmol/L氢氧化钠溶液的AG=12
D.常温下0.lmol/L盐酸溶液的AG=12
9、常温下,A溶液的PH=4,B溶液中的c(OH-)=1×10-12mol/L,C溶液中的c(H+)=1×10-3mol/L,D溶液中c(H+)与 c(OH-)的比值为1×104,则此四种溶液的酸性由强到弱的顺序为 ( )
A.DACB B.BCAD C.CADB D.ABCD

|
11、现有三种较稀的酸溶液(a)盐酸 (b)醋酸 (c)硫酸,分别加入足量锌,
试讨论下列两种情况放出H2的初速率和放出H2的总量.
| 初速率 | 氢气物质的量 | |
| (1)同体积同物质的量浓度 | ||
| (2)同体积同pH值 |
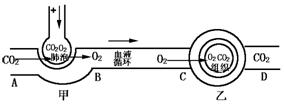 12、如图所示是某教师运用现代教育技术进行复习时放映的一个人体气体交换示意图,据图回答:
12、如图所示是某教师运用现代教育技术进行复习时放映的一个人体气体交换示意图,据图回答:
(1)甲图表示的过程称为 .
(2)健康人血液PH的范围是 .
A.8~9之间 B.7~8之间 C.9~10之间 D.等于7
(3)血管B内血液的PH 血管D内血液的PH(填“>”、“<”、“=”=,其原因是(用反应式说明) .
13、已知人的胃液PH在0.9~1.5左右为正常,当病人胃酸过多时,医生会让其服用NaHCO3中和掉部分H+.设病人胃液共AL,开始PH为a(a<0.9=服用NaHCO3后调至PH为b(0.9<b<1.5=.若服用药纯度为80%,求需服多少克小苏打?