第一节 化学反应速率 第二课时练习
一、单项选择题(共5题)
1、下列四种X溶液,分别放入盛有10mL2mol/LHCl烧杯中,加水稀释至50mL,X和HCl和缓进行反应,其中反应速率最大的是 ( )
A、20mL3mol/LX溶液 B、20mL2mol/LX溶液
C、10mL4mol/LX溶液 D、10mL2mol/LX溶液
2、对于反应M+N=P,如果温度每升高10℃,反应速率增加为原来的2倍,在10℃时完成反应的40%需要32min,将温度提高到40℃完成反应的40%需要的时间为 ( )
A、2min B、4min C、6min D、8min
3、对于简单反应aA(g)+bB(g)![]() cC(g)(a,b,c为系数),有如下化学反应速率特征:V正=k1[A]a[B]b,V逆=k2[C]c,其中k1和k2为只与温度有关的常数。如果缩小反应混合气体体积到原来的一半,则正反应速率增加到原来的
( )
cC(g)(a,b,c为系数),有如下化学反应速率特征:V正=k1[A]a[B]b,V逆=k2[C]c,其中k1和k2为只与温度有关的常数。如果缩小反应混合气体体积到原来的一半,则正反应速率增加到原来的
( )
A、a倍 B、b倍 C、2b倍 D、2a+b倍
4、某温度时,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后,c(X2)=0.4 mol·L-1,c(Y2)=0.8 mol·L-1,c(Z)=0.4 mol·L-1,则该反应式是 ( )
A、X2+2Y2![]() 2XY2 B、2X2+Y2
2XY2 B、2X2+Y2![]() 2X2Y C、X2+3Y2
2X2Y C、X2+3Y2![]() 2XY3
D、3X2+Y2
2XY3
D、3X2+Y2![]() 2X3Y
2X3Y
5、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A、加热 B、不用稀硫酸,改用98%浓硫酸
C、滴加少量硫酸铜溶液 D、不用铁片,改用铁粉
二、选择题(有1-2个正确答案,共5题)
6、NO和CO都是汽车尾气里的有害物质,它们缓缓地起反应生成氮气和CO2,对此反应,下列叙述正确的是 ( )
A、使用催化剂加快反速率 B、改变压强对反应速率无影响
C、降低压强能增大反应速率 D、升高温度能加大反应速率
7、恒容下的2SO2+O2![]() 2SO3+Q,达到平衡后,下列可以加快正反应速率的方法是
2SO3+Q,达到平衡后,下列可以加快正反应速率的方法是
( )
A、 将SO3分离出一部分 B、充入少量N2,增大压强
C、升温 D、充入少量SO3气体
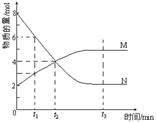 8、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是 ( )
8、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是 ( )
A、反应的化学方程式:2M![]() N
N
B、t2时,正、逆反应速率相等,达到平衡
C、t3时,正反应速率大于逆反应速率
D、t1时N的浓度是M浓度的2倍
9、下列措施肯定能使化学反应速率增大的是( )
A、增大反应物的量 B、增大压强
C、升高温度 D、使用正催化剂
10、设C+CO2![]() 2CO;△H>0,反应速率为v1,N2+3H2
2CO;△H>0,反应速率为v1,N2+3H2![]() 2NH3;△H<0 反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
( )
2NH3;△H<0 反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
( )
A、同时增大 B、同时减小
C、v1增大,v2减小 D、v1减小,v2增大
三、填空题(共5题)
11、将10molA和5molB放入10L的真空箱,某温度发生反应 3A(g)+B(g)![]() 2C(g)在最初0.2s内,消耗A的平均速率为0.06mol/(L·S),则在0.2s时,箱中有
2C(g)在最初0.2s内,消耗A的平均速率为0.06mol/(L·S),则在0.2s时,箱中有
molC生成。
12、Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2++I2(水溶液)。该反应正向反应速率和Fe3+、I-的关系为:v=k[c(I-)]m[c(Fe3+)]n(k为常数)
2Fe2++I2(水溶液)。该反应正向反应速率和Fe3+、I-的关系为:v=k[c(I-)]m[c(Fe3+)]n(k为常数)
| c(I-)/ mol·L-1 | c(Fe3+)/ mol·L-1 | V / mol/(L·S) | |
| ① | 0.20 | 0.80 | 0.032 k |
| ② | 0.60 | 0.40 | 0.144 k |
| ③ | 0.80 | 0.20 | 0.124 k |
通过以上数据计算得知:在v=k[c(I-)]m[c(Fe3+)]n中,m、n的值为
A、m=1 n=1 B、m=1 n=2 C、m=2 n=1 D、m=2 n=2
c(I-)对反应速率的影响 (填“大于”、“小于”、“等于”)c(Fe3+)对反应速率影响。
13、增加反应物的浓度、增大压强(有气体参加的反应)、升高温度和使用催化剂都可以增大反应速率。其中能增大反应物分子中活化分子百分数的 ,
理由是
。
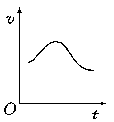 14、氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
14、氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
(1)反应开始进行时,反应速率加快的原因是
;
(2)反应后期,反应速率下降的原因是
 。
。
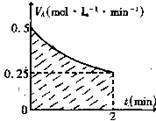
15、某溶液中发生反应:A![]() 2B+C,VA—t 的关系如图。已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
2B+C,VA—t 的关系如图。已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
(1)图中阴影部分的面积表示2min内 的减小值,应小于 ;
(2)2min时,B的物质的量浓度的取值范围是 。
