2005-2006学年长沙市高三调研测试(二)
化 学
2005.10
本试卷分选择题和非选择题两部分,共8页,满分为150分。考试用时120分钟。
可能用到的原子量:
H 1 He 4 C 12 N 14 O 16 Na 23 Al 27 Fe 56
第一部分选择题 (共68分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1. 据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:
HC≡C—C≡C-C≡C-C≡C-C≡N ,对该物质判断正确的是
A. 不能发生加成反应
B. 晶体的硬度与金刚石相当
C. 能使酸性高锰酸钾溶液褪色
D. 可由乙炔和含氮化合物加聚制得
2. 下列关于混合物的分离、提纯的方法错误的是
A.渗析法分离KI和淀粉
B.用浓溴水分离苯和苯酚
C.盐析法分离硬脂酸钠和甘油
D.用饱和NaHCO3溶液洗气除去CO2中少量的HCl气体
3. 砒霜中毒事件时有发生,砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用一定剂量的氧化剂解毒。下列有关叙述正确的是
A.砷原子最外层有3个电子
B.砷化氢(AsH3)比NH3稳定
C.砷酸(H3AsO4)的酸性强于磷酸
D.砷的+3价化合物的毒性强于+5价化合物
4.分别用pH为2和3的醋酸溶液中和等量的苛性钠溶液,设恰好中和时消耗醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A. V2=10V1 B. V2>10V1
C. V2<10V1 D. V1>10V2
5. 下列叙述不正确的是
A.电解时在阴极上发生还原反应
B.电镀时,阳极材料发生氧化反应
C.电解饱和食盐水时,阴极区产物为氢氧化钠溶液和氢气
D.原电池跟电解池连接后,电子从原电池负极流向电解池阳极
6. 在一容积可变的密闭容器中,通入1mol X和3 mol Y,在一定条件下发生如下反应
X (g) + 3 Y (g) ![]() 2 Z (g),到达平衡后, Y的转化率为a %, 然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b %。 则a与b的关系是
2 Z (g),到达平衡后, Y的转化率为a %, 然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b %。 则a与b的关系是
A. a = b B. a > b
C. a < b D. 不能确定
 7. 化学家从腐败草料中提取出双香豆素,结构简式如图。
7. 化学家从腐败草料中提取出双香豆素,结构简式如图。
1mol双香豆素与NaOH溶液反应,最多可消耗NaOH的物质的量是
A.2 mol B.4 mol
C.6 mol D.8 mol
8. 把铝粉和氧化亚铁粉配成铝热剂,分成两等份:一份在高温下恰好完全反应后, 再与足量盐酸反应,一份直接放入足量的烧碱溶液中充分反应;前后两种情况下生成的气体质量比是
A. 1∶1 B. 2∶3
C. 3∶2 D. 28∶9
二、选择题(本题包括11小题,每小题4分,共44分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9. A和B是第二或第三周期元素,可在同一周期,也可以在不同周期,两者可形成AmBn 型离子化合物,若A的原子序数为x,则B的原子序数不可能是
A.x – m– n + 16 B.x – m – n + 8
C.x + m + n – 8 D.x – m – n
10.下列各组中,两种气体的分子数目一定相等的
A.温度相同,体积相同的O2和N2
B.压强相同,体积相同的O2和N2
C.体积相等,密度相等的CO和C2H4
D.质量相等,密度不等的C2H4和N2
11.下列离子方程式正确的是
A. 碳酸钠溶于水中 CO32- + 2H2O
![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. 少量Ba(OH)2溶液与NaHSO4溶液反应
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O
C. 氯化亚铁溶液中通入少量氯气 Fe2+ + Cl2 = Fe3+ + 2Cl-
D. NH4HCO3溶液与过量NaOH稀溶液反应 NH4+ + OH- = NH3·H2O
12.甲酸的下列性质中,可以证明它是弱电解质的是
A. 1mol·L-1甲酸溶液的pH约为2
B. 甲酸能与水以任何比例互溶
C. 在相同条件下,甲酸溶液的导电性比强酸溶液的弱
D. 10mL1 mol·L-1甲酸恰好与10mL1 mol·L-1 NaOH溶液完全反应
13. 下列物质性质的变化规律与分子间作用力有关的是
A.F2、Cl2、Br2、I2的熔、沸点逐渐升高
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.HF、HCl、HBr、HI的热稳定性依次减弱
D.金刚石的硬度大于硅,其熔、沸点也高于硅
14. 一定条件下,向一带活塞的密闭容器中充入 2 mol SO2和 1 mol O2 ,发生以下反应:
2SO2(g) + O2(g) ![]() 2SO3(g) 到达平衡后,改变下列条件,SO3平衡浓度不变的是
2SO3(g) 到达平衡后,改变下列条件,SO3平衡浓度不变的是
A. 保持温度和容器体积不变,充入1mol SO3 (g)
B. 保持温度和容器压强不变,充入1mol SO3 (g)
C. 保持温度和容器压强不变,充入1mol SO2 (g)
D.保持温度和容器体积不变,充入1mol Ar (g)
15.在化学分析中,草酸(H2C2O4)是重要的还原剂,已知20.0mL 0.100 mol·L-1 VO2+离子恰好将20.0 mL 0.050 mol·L-1 H2C2O4完全氧化成CO2,VO2+被还原为VOn+离子,则VOn+中的n值为
A. 1 B. 2 C. 3 D. 4
16. 在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为P1,若控制容器的体积不变,加入足量的Na2O2,充分振荡并不断用电火花燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2,则P1和P2之间的关系是
A. P1=P2 B. P1=2P2
C. P1=4P2 D. P1=8P2
17.盛有氯化钡稀溶液的甲乙两试管分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是
A.甲试管没有白色沉淀生成而乙试管有
B.甲试管有白色沉淀生成而乙试管没有
C.甲、乙两试管都有白色沉淀生成
D.甲、乙两试管都没有白色沉淀生成
18. 常温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
19. A、B两种物质的饱和溶液的质量分数随温度变化的曲线如图。 现分别在50g A和80 g B中各加水150 g,加热溶解后并都蒸发掉水50 g ,冷却到t1℃,下列叙述正确的是
 A. t1℃时溶液中A、B的质量分数相等
A. t1℃时溶液中A、B的质量分数相等
B. t1℃时溶液中A的浓度小于B的浓度
C. t1℃时析出固体B
D. t1℃时两者均无固体析出
第二部分非选择题 (共82分)
三、(本题包括2小题,共20分)
20.(7 分)(1)下列实验操作正确的是 (填编号)。
A. 向一支洁净的试管中加人1mL 2% 硝酸银溶液,再向试管中滴加2% 的稀氨水至最初产生的沉淀恰好溶解为止。再滴加3滴乙醛溶液,振荡后热水浴中温热,片刻后试管内壁形成银镜。
B.实验室制取乙烯时,必须将温度计的水银球插入反应液中。
C.取2mL 10% NaOH溶液于试管中,加入4mL 2% CuSO4溶液,振荡后再加入某种有机试剂,热水浴中温热,可根据是否产生红色沉淀判断该有机物中是否含有醛基。
D.取20mL蒸馏水于50mL烧杯中,加热至沸,向沸水中滴加1 mL ~2mL FeCl3饱和溶液,持续加热片刻,即可制得Fe(OH)3胶体。
(2)已知5I- + IO3- + 6H+ = 3I2 + 3H2O,现只提供KI试剂,请利用家庭用品,设计一实验证明你家中食用盐是否属含碘(KIO3)盐。
。
21.(13分)高一教材有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一, 有氧气生成,第二, 。
Na2O2跟水反应的化学方程式是 。
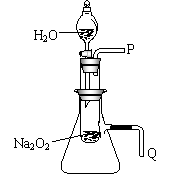 (2)某研究性学习小组拟用右图所示装置(气密性良好)
(2)某研究性学习小组拟用右图所示装置(气密性良好)
进行实验,以证明上述结论。
用以验证第一条结论的实验操作是:
;
用以验证第二条结论的实验方法是:
。
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。
请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: ;
现象: 。
 (4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
① 测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的
(忽略导管在量筒中所占的体积) (填序号),理由是
。
② 若在标准状况下测量气体的体积,应选用的量筒的大小规格为 (选填“100mL”“200 mL”“500 mL”或“1000 mL”)。
四、(本题包括2小题,共22分)
22.(9分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式 、
、 。
(2)C与D形成D的最低价化合物的电子式: 。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因: 。
23.(13 分)据下列信息完成所需回答的问题:
(1)氧化物A是高熔点白色固体,A在融熔状态下电解得到单质C;
(2)氧化物B是黑色固体,B与浓盐酸加热反应生成单质D;
(3)单质C与单质D反应生成M,其中单质C不溶于冷的浓硝酸。
(4)M与适量NaOH溶液反应生成沉淀G;
(5)G与NaOH溶液反应得到溶液N;G与盐酸反应得到溶液M。
请填空:
(1)A是 ;D是 (填化学式)
(2)元素C位于周期表的位置是 。
(3)写出下列反应的化学方程式
B+浓盐酸 ,
G+NaOH溶液
(4)单质C不溶于冷的浓硝酸的原因是 。
五、(本题包括2小题,共20分)
24.(10分)已知: CH3-CH=CH2 + HBr → CH3-CHBr-CH3
1mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A 在不同条件下能发生下图所示的一系列变化。
 |
(1)上述反应中,①是 反应,⑦是 反应。(填反应类别)
(2)写出C、D、E、H物质的结构简式:
C , D ,
E , H 。
(3)写出D → F反应的化学方程式 。
![]() 25.(10分)含有C、H、O三种元素的芳香族化合物A,其苯环上有两个取代基,且位置相邻。A的相对分子质量不超过200,分子中氧的质量分数为19.75%,该物质可使溴的CCl4溶液褪色,可发生银镜反应,能与钠反应产生氢气,但不能与NaOH溶液反应。已知具有烯醇式(
)结构的物质不稳定。
25.(10分)含有C、H、O三种元素的芳香族化合物A,其苯环上有两个取代基,且位置相邻。A的相对分子质量不超过200,分子中氧的质量分数为19.75%,该物质可使溴的CCl4溶液褪色,可发生银镜反应,能与钠反应产生氢气,但不能与NaOH溶液反应。已知具有烯醇式(
)结构的物质不稳定。
请用中学化学知识回答:
(1)A的相对分子质量为______________,A的分子式为________________________。
(2)写出符合题意的A的结构简式(任写三种)
_________________________________________________________________________。
六、(本题包括2小题,共20分)
26.(8分)为测定人呼出的气体中的二氧化碳的含量,将1000 mL(已按标准状况折算)呼出的气体通入50.0 mL氢氧化钡溶液中,使其完全吸收,过滤后取20.0 mL澄清溶液,用0.100 mol·L-1盐酸滴定,当消耗20.4 mL盐酸时恰好完全反应。另取20.0 mL原氢氧化钡溶液,用同种盐酸滴定,耗去36.4 mL盐酸时,恰好反应完全。试求人呼出气体中CO2的体积分数。
27.(12分)将40g铁粉放入600g稀硝酸中,若两者恰好完全反应,且稀硝酸被还原成NO,请计算:(1)稀硝酸的质量分数;(2)被还原的硝酸的物质的量。
2004-2005学年广州市高三化学调研测试(二)
化学模拟答题卡
学校: 姓名: 学号: 成绩:
| 题号 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 总分 |
| 得分 |
三、
20.(1) 。
(2)
。
21.(1) 。
。
(2) ;
。
(3) ;
。
(4)① ,
。
② 。
四、
22.(1) 、 、 、 。
(2) 。
(3) 。
23.(1) ; 。
(2) 。
(3) ,
。
(4)
。
五、
24.(1) , 。
(2)C ,D ,
E ,H ,
(3) 。
25.(1) , 。
(2)
。
六、
26.
27.
2004-2005学年广州市高三化学调研测试(二)
参考答案
第一部分选择题 (共68分)
一、(本题包括8小题,每小题3分,共24分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | B | D | B | D | A | B | A |
二、(本题包括11小题,每小题4分,共44分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 | C | CD | B | AC | A | BD | B | D | C | D | BC |
第二部分非选择题 (共82分)
三、(本题包括2小题,共20分)
20.(7分)
(1) A、B、D (各1分,共3分)
(2)用一洁净容器放入少量食用盐,加适量蒸馏水溶解,加适量食醋、少量KI试剂、少量淀粉,搅拌,观察溶液颜色。若变蓝色,证明食用盐含碘(KIO3)。若不变蓝色,则不含碘。
(4分)
21.(13 分)
(1)该反应是放热反应 (2分)
2Na2O2+2H2O = 4NaOH+O2↑ (2分)
(2)打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成。 (2分)
将导管Q浸入水中,反应过程中导管口有气泡冒出。 (2分)
(3)MnO2 ; 气泡迅速产生,能使带火星的木条复燃。 (各1分,共2分)
(4)① B ; 防止气体冷却时发生倒吸现象; ②500mL (各1分,共3分)
四、(本题包括2小题,共22分)
22.(9分)
(1) SO2 O3 H2O2 Na2O2 (各1分,共4分)
![]() (2)
(2分)
(2)
(2分)
(3) SO32-+H2O ![]() HSO3-+OH-
(3分)
HSO3-+OH-
(3分)
23.(13 分)
(1) Al2O3 ,Cl2 (各2分,共4分)
(2) 第三周期第ⅢA族 (2分)
(3) MnO2 + 4 HCl (浓) △ MnCl2 + Cl2↑+ 2 H2O (2分)
Al(OH)3 + NaOH = NaAlO2 + 2H2O (2分)
(4)在常温下,铝的表面被浓硝酸钝化,生成一薄层致密、坚固的氧化物保护膜,从而阻止内部的金属继续与浓硝酸发生反应。所以铝不溶于冷的浓硝酸。 (3分)
五、(本题包括2小题,共20分)
24.(10分)
(1)加成反应,酯化反应; (各2分,共4分)
![]()
 (2)
(2)
C: D:
 | |||
E: H:
(各1分,共4分)
![]()
(3)
(2分)
25.(10分) (1)162 , C10H10O2 (各2分,共4分)
(2)任写以下三种: (各2分,共6分)
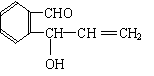 | |||
 | |||||
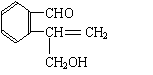 | |||||

六、(本题包括2小题,共20分)
26.(8分)Ba(OH)2 + CO2 = BaCO3↓ + H2O
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
原Ba(OH)2的浓度:
![]() (2分)
(2分)
吸收CO2后Ba(OH)2的浓度:
![]() (2分)
(2分)
n(CO2)= n(BaCO3)=(0.091 mol·L-1-0.051 mol·L-1)×50×10-3 L=0.002mol (2分)
![]() (2分)
(2分)
27.(12分)
由于反应Fe+2Fe3+ === 3Fe2+ 存在的可能性,题中“两者恰好完全反应”隐含三种情况,
设HNO3为xg ,被还原的HNO3为y mol :
(1)Fe恰好与HNO3反应生成Fe(NO3)3
Fe+ 4HNO3=== Fe(NO3)3+ NO↑+ 2H2O (1分)
56g 252g 1mol
40g xg ymol
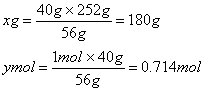
硝酸质量分数为:![]() (2分)
(2分)
被还原的硝酸:0.714mol (2分)
(2)Fe恰好与HNO3反应生成Fe(NO3)2
3Fe+ 8HNO3=== 3Fe(NO3)2+ 2NO↑+4H2O (1分)
168g 504g 2mol
40g xg ymol

硝酸质量分数为:![]() (2分)
(2分)
被还原的硝酸:0.476mol (2分)
(3)Fe与HNO3完全反应生成Fe(NO3)2和Fe(NO3)3
硝酸质量分数介于20%~30%之间,被还原的硝酸介于:0.476mol~0.714mol之间。 (2分)