2004学年第一学期联谊学校期中考试
高三化学试题卷
考试时间90分钟 命题人:萧山五中 陈尧良
一、选择题:(每小题只有一个选项正确,每小题2分)
1、100mL0.1mol/L醋酸与50mL0.2mol/L氢氧化钠混合,在所得溶液中 ( )
A.[Na+]>[CH3COO-]>[OH-]>[H+]
B.[Na+]>[CH3COO-]>[H+]> [OH-]
C.[Na+]>[CH3COO-]>[OH-]=[H+]
D.[Na+]=[CH3COO-]>[OH-]>[H+]
2、下列装置(如下图所示),能够构成原电池产生电流的 ( )
 |
3、下列说法中正确的是 ( )
A.一种分散质,分散到另一分散剂中,若分散系中的分散质粒子带电荷,这种分散系必为胶体
B.一种无色透明的液体,让一束光线通过时,无丁达尔现象,该液体必为溶液
C.一无色透明澄清的液态分散系,当加入电解质A时,液体中产生了白色沉淀,上述分散系必为胶体,加入A使胶体发生了凝聚
D.分散系中,分散质粒子直径介于10-9―――10-7m之间,这样的分散系必为胶体
4、下列各组在指定环境下能大量共存的是 ( )
A.pH=1的酸性溶液中:Na+、S2-、K+、MnO4-
B.pH=7的中性溶液中:Al3+、Cl-、SO42-、HCO3-
C.pH>7的碱性溶液中:Na+、AlO2-、SO42-、K+
D.pH=7的中性溶液中:Fe2+、ClO-、Na+、Cl-
5、有如下变化:
A+ne-===An-;ΔH=-a kJ·mol- B+ne-===Bn-;ΔH=-b kJ·mol-,且a>b
下列说法正确的是 ( )
A.氧化性A<B B.还原性An->Bn-
C.稳定性A>B D.稳定性An->Bn-
6、下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
7、下列关于晶体的说法中,正确的是 ( )
A.只要含有金属阳离子的晶体一定是离子晶体
B.离子晶体中一定含有阳离子和酸根离子
C.在分子晶体中原子与原子之间必定以共价健结合
D.原子晶体的熔、沸点均较高
8、微波是一种高频电磁波震荡,“微波炉”就是利用高频电磁波震荡使食品中分子也产生震荡而发热,现代医学上使用微波手术刀进行外科手术,其好处主要是使开刀处的血液迅速凝固而减少失血,关于其作用原理的说法正确的是 ( )
A.微波电流迅速中和血液胶粒所带的电荷而凝聚
B.微波使局部血液受热而使血液胶体发生聚沉
C.微波电流通过金属手术刀时产生的高温而使血液凝固
D.以上说法都正确
9、“中和热”是一个在热化学中的重要概念,“中和热”的定义为:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫做中和热。以下关于中和热的叙述正确的是 ( )
A.在稀溶液中所有酸和碱反应的中和热都相等
B.在稀溶液中强酸和强碱反应的中和热都相等
C.在稀溶液中1mol酸和1mol碱反应放出的热量都相等
D.将浓硫酸滴入氢氧化钠稀溶液中刚好生成1mol水时,产生的热量即为中和热。
10、下列反应的离子方程式书写正确的是( )
A.向碳酸氢铵溶液中加入过量的氢氧化钡溶液:
![]()
B.稀硝酸与亚硫酸钠反应:
![]()
C.将![]() 通入次氯酸钙溶液中:
通入次氯酸钙溶液中:
![]()
D.乙醛跟银氨溶液反应:
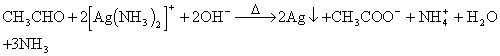
11、汽车在行驶过程中排放的尾气是城市污染的主要原因之一。为减少城市的大气污染,在汽车发动机和排气之间装配了催化转换器,催化转换器中装有铂(Pt)、铑(Rh)或过渡金属氧化物等作催化剂。催化转换器必须具备以下性能:即适用操作温度范围广,耐机械性冲击。因此,能作为催化剂的载体的材料是( )
A.聚四氟乙烯(塑料王) B.石墨
C.![]() D.晶体硅
D.晶体硅
12、甲、乙、丙、丁分别是![]() 四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是 ( )
四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13、下列各对物质中,属于同分异构体的是( )
A.![]() 与
与![]() B.
B.![]() 和
和![]()
C.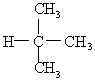 与
与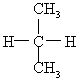
D.![]() 与
与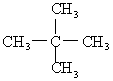
14、在食品加工或餐饮业中使用量特别要注意严加控制的物质是
A.氯化钠 B.谷氨酸钠(味精) C.碳酸氢钠 D.亚硝酸钠
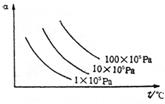
15、右图纵坐标为反应物的转化率α,横坐标为温度(t℃),下列符合此图情况的反应是( )
![]()
|
![]() B.H2+Br2(g) 2HBr;△H<0
B.H2+Br2(g) 2HBr;△H<0
![]() C.N2+3H2 2NH3;△H<0
C.N2+3H2 2NH3;△H<0
![]() D.2SO3(g) 2SO2+O2;△H>0
D.2SO3(g) 2SO2+O2;△H>0
16、从中草药茵陈蒿中可提取一种利胆的有效成分,其结构简式如下:
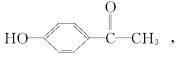 推测该药不可能具有的化学性质是 ( )
推测该药不可能具有的化学性质是 ( )
A.与氢氧化钠溶液反应 B.与碳酸氢钠溶液反应
C.与浓溴水反应 D.在一定条件下被还原成醇类物质
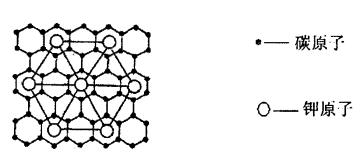
17、石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原了中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见右图。则x值为 ( )
A.8 B.12 C.24 D.60
18、以铁为阳极,以铜为阴极,对足量的NaOH溶液进行电解。电解过程中慢慢通入O2,一段时间后得到2molFe(OH)3沉淀,此间共消耗的水的物质的量为 ( )
A.2mol B.4mol C.4.5mol D.5mol
 19、已知AgCl能溶于氨水而生成[Ag(NH3)2]+。NH4Cl溶液和AgNO3溶液混合后再滴入NaOH溶液,溶液中沉淀量Y与NaOH溶液加入量的关系曲线不可能的是 ( )
19、已知AgCl能溶于氨水而生成[Ag(NH3)2]+。NH4Cl溶液和AgNO3溶液混合后再滴入NaOH溶液,溶液中沉淀量Y与NaOH溶液加入量的关系曲线不可能的是 ( )
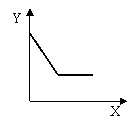
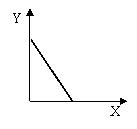
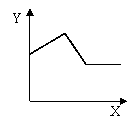 A. B. C. D.
A. B. C. D.
20、下列叙述中正确的是 ( )
A.原子晶体中,共价键的键能越大,熔沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
二、填空题
21、(4分)(1)向盛有乙二酸饱和溶液的试管中滴入少量用硫酸酸化的0.5%的KMnO4溶液,振荡发现紫红色消褪并有少量气泡出现。
写出该反应的离子方程式: 。
(2)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸生成SiO2和液态水。已知室温下10g甲硅烷自燃放出热量446kJ,
表示其燃烧热的热化学方程式为 。
22、(10分)图32-3所示:甲、乙为相互串联的两电解池.
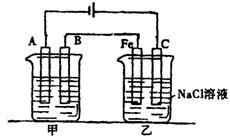
图32-3
试回答:
(1)甲池若为用电解原理精炼铜的装置,则A电极________极,电极材料是________,电极反应式为________,电解质溶液可以是________.
(2)乙池中Fe极电极反应式为___________________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈________色.
(3)若甲池A极增重12.8g,则乙池C(石墨)极放出气体在标况下的体积为________.
(4)电解后,若乙池剩余溶液为400mL,则溶液的pH=________.
23、(4分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是 和 ; 和 。
三、实验题
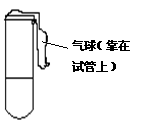 24、(6分)某学生采用不同试剂共进行了三组实验,每组步骤如下:
24、(6分)某学生采用不同试剂共进行了三组实验,每组步骤如下:
①用一支小试管取少量溶液A
②向A中通入过量气体X得到溶液B
③再在试管外套一只气球(气球内无气体,如图)
④加热试管得到液体C
⑤再冷却试管,又得到溶液B
试根据上述实验操作填写下表中有关内容。
| 溶液A名称 | X分子式 | 溶液B颜色 | 液体C现象 | |
| Ⅰ组 | 澄清石灰水 | CO2 | ① | ② |
| Ⅱ组 | ③ | ④ | 无色 | 红色溶液 |
| Ⅲ组 | ⑤ | ⑥ | 红色 | 溶液红色变浅 |
25、(14分)某化学研究学习小组的同学在做Na2O2与水反应时,向反应后的溶液滴加酚酞试液,溶液呈红色,但很快褪色。甲、乙、丙三同学分别对此现象做如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高而使红色褪去。
乙:因为加水的量较少,红色褪去可能是生成的NaOH浓度较大,即酚酞在高浓度的NaOH溶液不显红色。
丙:Na2O2与水反应(Na2O2不能存在于水中)后,溶液中可能存在强氧化性物质,它(们)氧化漂白了酚酞试液。
(1)验证甲同学的推测是否正确的方法是 。
(2)验证乙同学的推测是否正确的方法是 。
(3)当出现 现象时,即可说明丙同学的推测正确。
(4)有同学提出用定性方法探究丙同学推测的溶液中可能存在强氧化性物质是H2O2的方法是 。
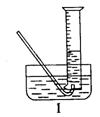
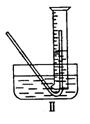 (5)有同学提出用定量方法探究丙同学推测的溶液中可能存在强氧化性物质是H2O2的方法:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用右图装置中的
,理由是
。②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(填“100mL”、“200mL”、“500mL”或“1000mL”。
(5)有同学提出用定量方法探究丙同学推测的溶液中可能存在强氧化性物质是H2O2的方法:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用右图装置中的
,理由是
。②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(填“100mL”、“200mL”、“500mL”或“1000mL”。
四、有机题
26、(10分)已知R—CH=CH2+H2O![]() RCHOHCH3。现有含C、H、O的有机物A——F,相互之间的转化关系如下图所示:
RCHOHCH3。现有含C、H、O的有机物A——F,相互之间的转化关系如下图所示:
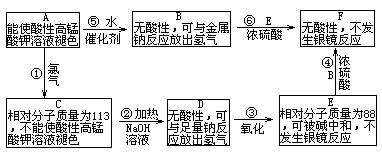
(1)化合物A→F相互转化的关系中属于取代反应的有______ _(填反应序号);
(2)化合物A和D的结构简式为:
A_ _____,D____ ____。
(3)反应④
五、计算题
27、(6分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的式量以17.0计,水的密度以1.00g/cm3计)
28、(6分)接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收SO3。某工厂接触室“出口气体”中含有N2、O2、少量SO2和体积分数为10%的SO3。把“出口气体”送进吸收塔,使SO3转化成发烟硫酸(H2SO4和SO3的混合物),其中SO3的质量分数为20%,请计算(不必写出计算过程,保留三位有效数字):(1)若发烟硫酸用H2SO4•XSO3表示,则X的值是
(2)工业上用于吸收SO3的浓硫酸的浓度为 ,原因是 。
(3)若现在只用98%的浓硫酸来完全吸收SO3生产发烟硫酸,448m3(已折算成标准状况)“出口气体”所需要用的98%的浓硫酸的质量是 Kg。