分子结构 晶体结构复习专项训练 (时间:45分钟)
一、选择题(有1—2个正确答案)
1、下列不属于离子化合物的是( )
A.Na2O2 B.CaF2 C.SO2 D.Ba(OH)2
2、下列电子式中错误的是( )
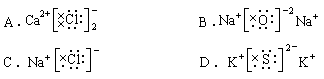
3、X-、Y+、Z2-、W-四种离子的电子层数为n或(n-1),离子半径Z2-> W-> X-> Y+,则四种元素的质子数为( )
A.W>Z>Y>X B.Z>W>Y>X
C.X>Y>Z>W D.X>Y>W>Z
4、A元素的最高正价和负价的绝对值之差为6,B元素和A元素的原子次外层都有8个电子,BA2在水溶液中电离出电子层结构相同的离子,则BA2是( )
A.MgF2 B.CaCl2 C.K2S D.Na2O
5、离子半径最接近下列( )
A.2×10-8米 B.2×10-10米
C.2×10-10厘米 D.2.5×10-5米
6、下列叙述错误的是( )
A.原子间通过共用电子对形成的化学键叫共价键。
B.键长越短,该键越稳定。
C.键能越大,表示该键越稳定。
D.键角越大,表示该分子越稳定。
7、下列各组物质中,化学键类型不同的是( )
A.NaCl和HNO3 B.H2O和NH3
C.CaF2和CaCl D.CCl4和Na2O
8、已知氢分子键能436 kJ/mol,氧分子的键能493 kJ/mol,氯分子的键能247 kJ/mol,氮分子的键能946 kJ/mol,则下列途述正确的是( )
A.N—N键能为![]() kJ/mol。
kJ/mol。
B.氮分子中的共价键比氢分子中共价键键长短。
C.氧分子中氧原子是以共价单键结合的。
D.氮分子比氯分子稳定。
9、下列说法中正确的是( )
A.原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数。
B.离子化合物中只有离子键,共价化合物中只有共价键。
C.氨分子中氢、氧原子的化合价均已饱和,不能再与其它原子或离子成键。
D.铵离子呈正四面体构型。
10、以下化合物中,同时含有离子键,共价键和配位键的是( )
A.NH4HCO3 B.HNO3 C.KOH D.SO3
11、下列分子中,具有极性键的非极性分子是( )
A.H2O B.CS2 C.NH3 D.CH4
12、带电的玻璃棒可使下列液体线状下流的方向发生偏转的是( )
A.二硫化碳 B.水 C.液溴 D.四氯化碳
13、g服分子间作用力能发生的变化是( )
A.物理化学变化 B.既不是物理变化,又不是化学变化。
C.只是物理变化 D.只是化学变化。
14、下列物质中,属于原子晶体的化合物是( )
A.水晶 B.晶体硅 C.金刚石 D.干冰
15、某元素的单质X与另一元素的单质Y在一定条件下化合生成Z,Z在常温下呈气态,当改变条件使其固化时,得到的晶体是( )
A.分子晶体 B.原子晶体 C.离子晶体 D.无法准确判断
16、固体属于离子晶体,含有非极性键,且与水反应后又生成非极性分子的是
( )
A.FeS2 B.NaOH C.Na2O2 D.Na2O
17、下列说法中错误的是( )
A.分子间力是一种较弱的化学键,键能较低。
B.由于分子晶体和原子晶体内的作用力不同,故它们的熔沸点差别比较大。
C.非极性分子和极性分子都可以形成分子晶体。
D.原子晶体中,各原子间以共价键结合,所以不存在单个的分子。
18、下列各组物质,前者的沸点高于后者的是( )
A.干冰与固态二硫化碳。 B.NaCl晶体与KCl晶体。
C.金刚石与晶体硅。 D.干冰、氧化钠、二氧化硅。
19、最近科学家研究出一种新的分子,它具有空心类似足球的结构,分子式为12C60,下列有关说法正确的是( )
A.12C60是一种新型化合物。 B.12C60和石墨是碳的同素异形体。
C.12C60具有离子键。 D.12C60分子量为720。
20、M元素的一个原子失去两个电子,转移到Y元素的两个原子中去,形成离子化合物R,下列有关说法中错误的是( )
A.R的溶点高。 B.R可表示为M2Y。
C.R一定溶于水。 D.M形成+2价阳离子
二、填空题:
21、填写满足下列条件的元素:
(1)正二价阳离子的电子层结构与氩原子相同的元素是 。
(2)正三价阳离子的电子层结构与F-相同的元素是 。
(3)负二价阴离子的电子层结构与K+相同的元素是 。
(4)第二周期中,原子的电子层数与价电子数相等的元素是 。
22、写出具有11个质子和10个电子的三种微粒的电子式为 、 、 。
23、在一定条件下,金属钠与氢气可以化合生成离子化合物NaH,用电子式表示其形成过程: 。
24、H2S、HF、HCl、HI、CH4、NH3、H2O、MgO、CO2、SO2、NaCl、NaOH等化合物,按下列要求填空:
(1)具有强极性键的物质的水溶液是弱酸的是 ;具有强极性键的物质的水溶液是强酸的是 ;具有弱极性键的物质的水溶液是强酸的是 ;水溶液是弱碱的是 ,是强碱的是 。
(2)属于离子化合物的是 、 、 ,其中既有离子键,又有共价键的化合物的电子式是 。
(3)固体属于分子晶体的氧化物是 、 、 ;属于离子晶体的氧化物是 ;属于极性分子化合物是 、 ,非极性分子的氧化物是 。
三、计算推断题:
25、A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期。A显负价时,不能被任何氧化剂氧化;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,C1、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒。回答:
1、写出五种微粒的符号:A 、B 、C 、D 、E 。
2、C的同位素名称和符号:C1 、C2 、C3 。
3、A与B形成的化合物中存在 键,其晶体是 晶体;C与D形成分子的电子式为 ,结构式为 ,空间构型是 ,它是 (极性或非极性)分子;D单质的电子式为 ,结构式为 ,它是 (极性或非极性)分子。
【答案与提示】:
一、选择题:
1、C 2、A、B 3、A(可采用具体物质代入法,假设Z2-为S2-,则W-为Cl-、X-为F-,Y+为Na+,即可准确得出Z、W、X、Y质子数的关系。)
4、B(氟元素无正价) 5、B 6、D
7、A、D 8、D 9、D 10、A 11、B、D
12、B 13、C 14、A 15、A 16、C
17、A 18、B、C 19、B、D 20、B、C
二、填空题:
21、(1)Ca (2)Al (3)S (4)Be
22、Na+,NH4+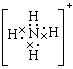 ,H3O+
,H3O+![]()
23、Na![]() +·H
+·H![]() Na+
Na+![]()
24、(1)H2S,HF;HCl;HI;NH3,MgO;NaOH。
(2)MgO,NaCl,NaOH;![]() 。
。
(3)H2O,CO2,SO2,MgO;H2O,SO2,CO2
三、计算推断题:
1、A—F,B—Na,C—H,D—N,E—OH-。
2、C1:氕 H C2:氘D C3:氚 T
3、离子,离子;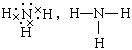 ,三角锥型,极性;
,三角锥型,极性;![]() ,非极性。
,非极性。