高中毕业班化学第一次调研测试
化 学 试 题
注意事项:
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,本试卷满分100分。考试时间90分钟。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Cl—35.5
第Ⅰ卷(选择题,共54分)
选择题(本题包括18小题,每小题只有一个选项符合题意,每题3分,共54分)
1.某地发生了食用熟牛肉中毒事件,导致四个死亡、一百多人中毒。经过对该牛肉的检测,发现其中某盐的含量比国家标准允许的含量高800多倍,则该盐可能是 ( )
A.NaNO2 B.NaNO3 C.NaCl D.BaSO4
|
|
|
|
C.镁离子结构示意图 D.硫离子结构示意图
3.下列事实与胶体性质无关的是 ( )
A.FeCl3溶液用于止血 B.硅胶的电泳现象
C.明矾用于净水 D.药皂里加硫
4.下列实验操作或对实验事实的叙述不正确的是 ( )
A.用酸式滴定管最取20.00mL 0.1mol·L—1 KMnO4溶液
B.用氨水除去Mg2+溶液中的Al3+
C.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
D.用稀HNO3清洗做过银镜反应实验的试管
5.在pH=0溶液中,下列各组离子因发生氧化还原反应而不能大量共存的是 ( )
A.Ag+、Ca2+、Cl—、CO32— B.Cl—、SO32—、K+、Na+
C.Fe2+、Na+、K+、NO3— D.K+、Na+、Br—、Cl—
|
v(H2O)表示,则正确的关系式为 ( )
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO)
7.下列反应中调节反应物用量或浓度,反应产物不会改变的是 ( )
A.碳在氧气中燃烧 B.二氧化硫通入石灰水中
C.硫酸加入锌粉 D.铁在氯气中燃烧
8.下列根据实验现象所得出的结论一定正确的是 ( )
A.某无色溶液滴加酚酞试液后显红色,结论:溶液显碱性
B.某无色溶液加入盐酸产生无色无味气体,结论:溶液中一定含有CO32—
C.某气体能使品红溶液褪色,结论:该气体为SO2气体
D.电解某无色液体得到H2和O2,测其体积比为2:1,结论:此液体为纯水
9.下列叙述正确的是 ( )
A.分子晶体中都存在共价键
B.F2、Cl2、Br2、I2的溶沸点逐渐升高与分子间作用力有关
C.非极性分子中一定不含极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
|
A.pH=7 B.pH>7 C.pH<7 D.无法确定
11.设NA为阿伏加德罗常数,则下列说法中正确的是 ( )
A.78g Na2O2晶体中所含阴阳离子个数均为2NA
B.1.5g CH3+中含有的电子数为NA
C.3.4g氨中含有0.6NA个N—H键
D.常温下,100mL 1mol·L—1 AlCl3溶液中阳离子总数小于0.1NA
12.下列离子方程式正确的是 ( )
A.氨水中通入少量二氧化硫:2NH3·H2O+SO2 2NH4++SO32—+H2O
B.NaHCO3和Ba(OH)2两溶液混合:Ba2++CO32— BaCO3↓
C.碳酸钙溶于醋酸:CaCO3+2H+ Ca2++H2O+CO2↑
D.Fe与FeCl3溶液反应:Fe+Fe3+
2Fe2+
13.已知在25℃,101Kpa下,1g C8H18燃烧生成二氧化碳和液态水时放出48.40kJ热量,表示上述反应的热化学方程式正确的是 ( )
A.C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol—1
B.C8H18(l)+12.5 O2(g)=8CO2(g)+9H2O(l);△H=-5517.6kJ·mol—1
C.C8H18(l)+12.5 O2(g)=8CO2(g)+9H2O(l);△H=+5517.6kJ·mol—1
D.C8H18(l)+12.5 O2(g)=8CO2(g)+9H2O(l);△H=-48.40kJ·mol—1
14.用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否。下列类推结论中正确的是 ( )
A.Na失火不能用CO2灭火,K失火不能用CO2灭火
B.工业上电解熔融MgCl2制取金属镁,也用电解熔解AlCl3的方法制取金属铝
C.Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3
D.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可写成PbO·Pb2O3
|
3CO下列叙述正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中生生成2mol AlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
16.已知:2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O
Cl2+2FeCl2 2FeCl3;2KI+2FeCl3 2KCl+I2+2FeCl2
下列判断正确的是 ( )
A.氧化性:MnO4—>Cl2>I2>Fe3+
B.还原性:Fe2+>I—>Cl—
C.Fe3+只有氧化性,Fe2+只有还原性
D.FeCl3能使湿润的淀粉KI试纸变蓝
|
18.下列说法正确的是 ( )
A.pH=2与pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液中c(Na+)与c(CO32—)之比为2:1
C.0.2mol·L—1与0.1mol·L—1醋酸中c(H+)之比为2:1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
|
19.(8分)已知反应AgF+Cl2+H2O→AgCl↓+AgClO3+HF+O2(未配平)
(1)若Cl2的化学计量数为a,则AgF的化学计量数为 。
(2)若AgClO3的化学计量数为b,O2的化学计量数为c,则AgCl的化学计量数为
,判断的依据是 。
(3)若O2的化学计量数为1时,反应中电子转移的总量为 mol。
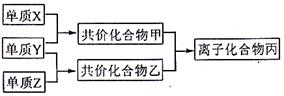
20.(9分)A、B、C、D、E为五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的![]() 倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:
倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:
(1)写出下列元素的元素符号:B ;D 。
(2)C与E形成化合物时化学键的类型是 。
(3)D与C的氧化物水化物在溶液中反应的离子方程式为
|
(4)用A元素的单质和B元素的单质制成的新型化学
电源已在宇宙飞船中使用。如右图所示,两个电
极均由多孔性材料制成,气体由空隙中通入,并
在电极表面放电。①a是 极。②b极的
电极反应式为:
。
|
已知:在常见双原子单质分子中,X分子含共价键最多;甲分子含10个电子,乙分子含18个电子。
|
(1)X的电子式是 。
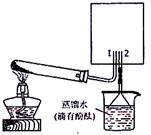
(2)实验室可用下图所示装置(缺少收集装置,
夹持固定装置略去)制备并收集甲。
|
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
(3)磷在单质Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外电子层均满足8电子结构,丁的化学式是 。
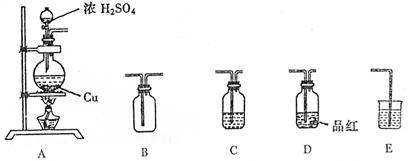
22.(13分)为了探究铜与浓硫酸的反应,选用以下装置
|
(1)装置A中发生反应的化学方程式 。
(2)若要使B中收集满干燥的SO2气体(应能证实B中已收集满)请写出上述装置的连接顺序: 接 接 接 接 。
(3)C和E装置中所盛装的试剂名称为C E ;E的作用是
。
(4)证明B中已收集满SO2的方法是 .
(5)实验中,取一定质量的铜片和一定体积、浓度的18mol·L—1的浓硫酸共热,至反应停止,发现反应器中仍有铜片剩余,此时溶液中是否还会有一定量的酸剩余,
(填“有”或“没有”),说明分析理由
。
23.(8分)将1mol CO和1mol H2O(g)充入某固定容积的反应器中,在某条件下达到平衡:
![]() CO+H2O(g) CO2+H2,此时有
CO+H2O(g) CO2+H2,此时有![]() 的CO转化为CO2。
的CO转化为CO2。
(1)该平衡混合物中CO2的物质的量分数为 。
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,CO的转化率
(填“增大”、“减小”、“不变”)
(3)温度不变的条件下向该平衡体系中再充入1mol CO2和1mol H2,则达新平衡时CO2的物质的量分数为 。
(4)若在相同条件下,开始时向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是下列各值中的 (填编号)
A.16.67% B.27.55% C.33.3% D.36.8%
参考答案
选择题(每小题3分,共54分)
|
|
19.(每空2分,共8分)(1)2a (2)5b+4c,得失电子守恒(或化合价升降守恒)
(3)9mol
20.(1)O(1分);Al(1分) (2)离子键(1分)
(3)2Al+2OH—+2H2O=2AlO2—+3H2↑(2分)
![]()
![]() (4)①负(2分) ②O2+4e—+2H2O=4OH—(2分)
(4)①负(2分) ②O2+4e—+2H2O=4OH—(2分)
21.(1):N N: (1分)
(2)①B(1分) ②NH4Cl、Ca(OH)2(2分)(合理答案均给分)
![]() ③NH3·H2O NH4++OH—(2分)
③NH3·H2O NH4++OH—(2分)
(3)PCl3(2分)
22.(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2分)
(2)A接C接B接D接E(2分)
(3)C浓硫酸(1分) E氢氧化钠(1分);吸收多作的SO2气体,防止污染空气(2分)
(4)装置D中品红溶液变浅(或褪色)(2分)
(5)有(1分) 反应过程中硫酸被消耗,且反应中生成水,使浓硫酸浓度变稀,而稀硫酸不与铜反应。(2分)
23.(1)25%(2分) (2)不变(2分) (3)25%(2分) (4)B(2分)
| |