高三年级化学第一次模拟考试试卷
命题 季锡根 校对 高三备课组
本卷可能用到的相对原子质量:C 12 O 16 Na 23 Si 28 S 32 Cu 64
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
1.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
2Ag+Zn(OH)2![]() Ag2O+Zn+H2O
Ag2O+Zn+H2O
在此电池放电时,负极上发生反应的物质是.
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
2.下列化学用语表达正确的是
3.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为
A.原子晶体 B.分子晶体 C.离子晶体 D.金属晶体
4.下列实验操作正确的是
A.用带橡皮塞的棕色细口瓶盛放浓硝酸
B.滴定管经蒸馏水润洗后,即可注入标准液进行滴定
C.用干燥清洁的玻璃棒蘸取某溶液点在pH试纸中部,跟标准比色卡比较来测定该溶液的pH
D.配制溶液时加水超过容量瓶的标线,用滴管把多余的液体吸出
5.下列关于实验的描述不正确的是
A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏低
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方
C.在镀件上电镀铜时,可用金属铜作阳极
D.在用Fe(OH)3胶体溶液做电泳实验时,阴极区红色加深,可知Fe(OH)3胶体粒子带正电荷
6.向饱和澄清石灰水中加入生石灰,再恢复到原温度,下列说法正确的是
A.Ca2+浓度减小 B.溶剂质量减小
C.溶液质量不变 D.Ca2+数目增多
7.某溶液中含有SO42-、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1∶2∶4,则离子M可能是
A.H+ B.K+ C.Cl- D.Ba2+
8.由H2SO4、Al2O3、NaOH、Mg、Cl2两两之间进行反应,可制得的正盐有
A.5种 B.6种 C.7种 D.8种
9.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③17.6g CO2 ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度③>②>④>①
c.电子总数②>③>①>④ d.原子总数①>③>②>④
A.abcd B.bcd C.acd D.abc
10.右图a曲线是198K时N2与H2反应过程中能量变化的示意图。下列叙述正确的是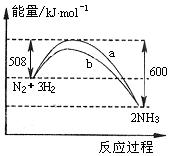
A.该反应的热化学方程式为:
N2
+ 3H2![]() 2NH3 △H =-92kJ·mol-1
2NH3 △H =-92kJ·mol-1
B.向一密闭容器中加入1molN2和3molH2充分
反应后,放出92kJ热量
C.b曲线是加入催化剂时的能量变化曲线
D.加入催化剂可增大正反应速度,降低逆反应速率
11.设阿伏加德罗常数的值为NA,下列叙述正确的是
A.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
B.0.1mol ![]() Br原子中含中子数为3.5NA
Br原子中含中子数为3.5NA
C.6.0g SiO2晶体中含有的硅氧键数目为0.4NA
D.7.8g过氧化钠中所含有的阴离子数为0.2NA
12.关于下列各装置图的叙述中,不正确的是
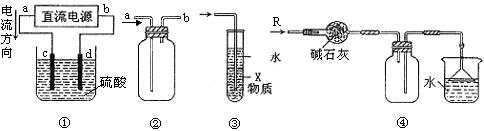
A.装置①中,c、d分别为石墨电极,则c极得到O2、d极得到H2
B.装置②可用于收集NO气体
C.装置③中X若为四氯化碳,可用于吸收氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
13.实验室常用MnO2与浓盐酸共热制取C12,也可用KC1O3、KMnO4、K2Cr2O7代替MnO2
与浓盐酸反应制C12,其中KClO3→Cl2 KMnO4→Mn2+ K2Cr2O7→Cr3+。若制取等量
的C12,电子转移数最少是
A.MnO2 B. KC1O3 C.KMnO4 D.K2Cr2O7
14.某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。

实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是
A.钠着火燃烧产生苍白色火焰
B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.管右端棉球外颜色变化可判断氯气是否被碱液完全吸收
15.在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为
A.2 mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.7.5 mol·L-1
16.下列用来表示物质变化的化学用语中,错误的是
A.钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-= 4OH-
B.向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+
C.1L0.5mol·L-1稀硫酸与1L1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量:
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);![]() H=-114.6kJ·mol-1
H=-114.6kJ·mol-1
D.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:
SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O
17.做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平)。关于此反应的叙述正确的是
A.该反应的氧化剂是H2C2O4
B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH-
D.配平该反应后,H+的计量数是6
18.2008年北京奥运会“祥云”奥运火炬所用环保型燃料丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5 kJ·mol-1;正丁烷的燃烧热为:2878kJ·mol-1;异丁烷的燃烧热为:2869kJ·mol-1。下列有关说法正确的是
A.丙烷燃烧的热化学方程式可表示为:
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);ΔH=-2221.5 kJ·mol-1
B.正丁烷燃烧的热化学方程式可表示为:
2C4H10(g)+18O2(g)=8CO2(g)+10H2O(l);ΔH=-2878 kJ·mol-1
C.正丁烷转化为异丁烷的过程是一个放热过程
D.正丁烷比异丁烷稳定
二、本题共有5小题(共56分)。
19.(8分)根据水在化学反应中的作用,按要求完成下列氧化还原反应的化学方程式:
(1)水只作氧化剂:
(2)水只作还原剂:
(3)水既作氧化剂,又作还原剂:
(4)水既不作氧化剂,又不作还原剂:
20.(10分)已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图
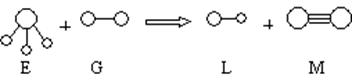
回答下列问题:
(1)M的电子式 。
(2)E是由 键构成的 分子(填“极性”或“非极性”)。
(3)组成G的元素在周期表中的位置 。
(4)上述反应中氧化剂与还原剂的物质的量之比为 。
21.(12分)
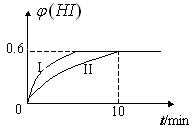 (I)将1molI2(g)
和2molH2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
(I)将1molI2(g)
和2molH2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g);
2HI(g);![]() H<0。2min时,测得I2的物质的量为0.6mol。10min后达到平衡,HI的体积分数
H<0。2min时,测得I2的物质的量为0.6mol。10min后达到平衡,HI的体积分数![]() 随时间变化如下图中曲线II所示。
随时间变化如下图中曲线II所示。
请回答下列问题:
(1)前2min内,用H2表示的平均反应速率为
mol·L-1·min-1。
(2)达到平衡时,I2(g)的物质的量浓度为 mol·L-1。
(3)若改变反应条件,在某条件下![]() 的变化如 上图曲线I所示,则该条件可能是
的变化如 上图曲线I所示,则该条件可能是
(填入下列条件的序号)
①恒容条件下,升高温度 ②恒容条件下,降低温度
③恒温条件下,缩小反应容器的体积 ④恒温条件下,扩大容器的体积
⑤恒温恒容条件下,加入适当的催化剂
(II)有下图所示的装置:
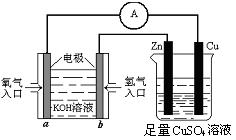
(1)该装置中铜片电极名称为 极,b极的电极反应式为 。
(2)当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为 L。
22.(14分)由两种固体组成的混合物A可以发生如下框图所示的一系列变化。
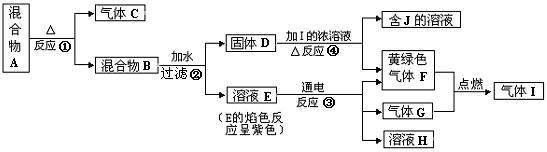
(1)按要求写方程式:
反应①的化学方程式 ;
反应③的离子方程式 ;
反应④的离子方程式 ;
(2)根据下图回答问题:
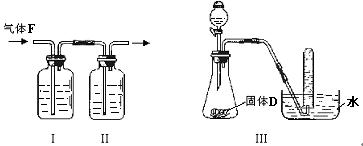
①在实验室中要获得干燥纯净的黄绿色气体F,可以将它通过如图I、II所示的装置,其中瓶I中盛放的是 ,目的是 ;
②用图III装置制取并证明气体C,分液漏斗内盛放的液体是 ,试管中收集满气体后,下一步实验操作是: 。
23.(12分)向浓度相同、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL。
(1)在稀释后的A、B溶液中分别逐滴加入0.1mol·L-1的盐酸,产生的CO2体积(标准状况)与所加盐酸的体积关系如下图所示。
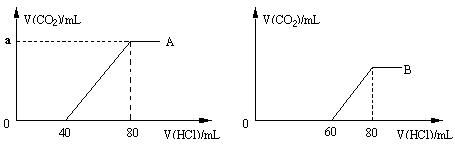
① A曲线表明,在NaOH溶液中通入一定量CO2后,溶液中溶质是
(填化学式), a值为 (标准状况)。
② B曲线表明,当0<V(HCl)≤60时,涉及反应的化学方程式为 。
(2)原NaOH溶液的物质的量浓度为_________mol·L-1,B溶液最多还能吸收CO2体积为 (标准状况)。
浦江县高三年级第一次模拟考试
化学答卷纸
一、选择题(每小题3分,共54分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
二、本题共有5小题(每空2分,共56分)。
19.(8分)
(1) ;
(2) ;
(3) ;
(4) ;
20.(10分)
(1)M的电子式 。
(2)E是由 键构成的 分子。
(3) 。
(4) 。
21.(12分)
(I)(1) mol·L-1·min-1。(2) mol·L-1。(3)
(II)(1) 极,b极的电极反应式为 。
(2) L。
22.(14分)
(1)反应①的化学方程式 ;
反应③的离子方程式 ;
反应④的离子方程式 ;
(2)①瓶I中盛放的是 ,目的是 ;
②分液漏斗内盛放的液体是 ,
下一步实验操作是:
。
23.(12分)
(1)①溶液中溶质是 ,a值为 (标准状况)。
②化学方程式
。
(2) mol·L-1,吸收CO2体积为 (标准状况)。
高三年级第一次模拟考试
化学答卷纸
一、选择题(每小题3分,共54分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | D | A | C | A | B | B | C | A | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| |
| C | B | B | A | B | B | D | C |
| |
二、本题共有5小题(每空2分,共56分)
19.(8分)
(1)2Na+2H2O=2NaOH+H2↑(2)2F2+2H2O=4HF+O2
(3)2H2O![]() 2H2↑+O2↑ (4)2Na2O2+2H2O=4NaOH+O2↑
2H2↑+O2↑ (4)2Na2O2+2H2O=4NaOH+O2↑
(其它合理答案也给分)
20.(10分)
(1)![]() (2)极性、极性
(2)极性、极性
(3)第二周期第 ⅦA族 (4)3∶2
21.(12分)
(I) (1)0.1 (2)0.05 (3)③⑤
(II) (1)阳极 H2+2OH--2e-=2H2O (2)2.24
22.(14分)
(1)①2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
③2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
④MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)①饱和食盐水 除去Cl2的HCl
②H2O2 把导管移出水面,关闭分液漏斗活塞,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
23.(12分)
(1)①Na2CO3 89.6
②NaOH+HCl=NaCl+H2O Na2CO3+HCl=NaHCO3+NaCl
(2)0.16 134.4mL