理科综合能力测试[化学部分](二)
第Ⅰ卷
(选择题,每小题6分,共48分)
在下列各题的四个选项中,只有一个选项是符合题目要求的。
以下数据可供解题时参考:
原子量:H 1,C 12,N 14,O 16,Na 23,S 32,Cl 35.5,Fe 56,Cu 64,Zn 65
1.氢元素有三种同位素:H、D、T,氯元素有两种同位素![]() 、
、![]() ,当用一种仪器测定由氢、氯两种元素原子组成的HCl分子的质量,所得到的数值有
,当用一种仪器测定由氢、氯两种元素原子组成的HCl分子的质量,所得到的数值有
A.2种 B.5种 C.6种 D.9种
2.NaCl晶体结构如下图所示,现测知NaCl晶体中Na+与Cl—平均距离为a cm,该晶体密度为ρg·cm—3,则阿伏加德罗常数可表示为
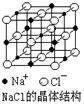 A.
A.![]() B.
B. ![]()
C.![]() D.
D. ![]()
3.白铁皮在发生析氢腐蚀时有0.2 mol电子转移,下列说法正确的是
A.有5.6 g金属被腐蚀 B.有6.5 g金属被氧化
C.有0.15 mol金属失去电子 D.标准状况下有4.48 L H2逸出
4.室温下,在pH=12的某溶液中,由水电离的[OH— ]为
①1.0×10—7 mol·L—1 ②1.0×10—6 mol·L—1
③1.0×10—2 mol·L—1 ④1.0×10—12 mol·L—1
A.只有① B.①或②
C.只有④ D.③或④
5.我们可以用水解度h表示盐的水解程度的大小,它是用已水解的电解质的物质的量占原来总的电解质的物质的量百分数来表示的。若测得2 L 0.1mol·L—1的强碱弱酸盐NaA溶液的pH值为10,则A—离子的水解度h为
A.0.01% B.0.1% C.0.2 % D.1%
6.只含C、H、O三种元素的有机物,在空气中燃烧时消耗的O2和生成的CO2的体积比是1:2,在这类有机物中
A.相对分子质量最小的化合物分子式是CH2O
B.相对分子质量最小的化合物分子式是C2H2O
C.含相同碳原子数的各化合物,其相对分子质量之差是16的整数倍
D.含相同碳原子数的各化合物,其相对分子质量之差是18的整数倍
7.在一定温度下,将一包白色无水硫酸铜粉末投入到150 g蒸馏水中,充分搅拌过滤得到一定质量的蓝色晶体和84 g滤液。又知此温度下无水硫酸铜的溶解度为40 g,则此包无水硫酸铜的质量是
A.60 g B.66 g C.90 g D.184 g
8.发展绿色食品是提高人类生存质量的重要措施。绿色食品是指
A.绿颜色的营养食品 B.含叶绿素丰富的营养食品
C.安全、无公害的营养食品 D.附加值高的营养食品
第Ⅱ卷
(非选择题,共3小题,共50分)
9.(16分)NaCl样品中混有少量的CaCl2和NaBr,按下列程序操作可制得纯净的NaCl。
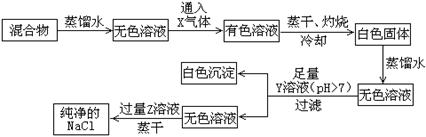
(1)X气体是___________,Y溶液是____________,Z溶液是______________。
(2)过滤时,除漏斗外还需要的玻璃仪器有_______________________________。
(3)加入Y溶液的目的是_____________________________________________;若在不使用pH试纸的情况下,检验Y溶液是否足量的方法是(简要回答操作过程及现象)________________________________________________________________________。
10.(16分)下图A~K都是中学化学实验中使用的或能够制备的物质,已知A~K物质中部分是某二价金属元素X的化合物,有一些是含常见非金属元素Y的物质,且C、E、G、K是气体,物质间有如下反应关系:
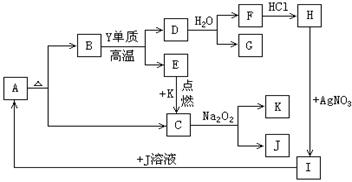
请填写:
(1)元素X的符号_________,元素Y的名称_________。
(2)写出反应D→G+F的化学方程式__________________________________。
(3)写出反应C→K+J的化学方程式___________________________________。
(4)除I外,还有___________(填字母)能与J溶液反应生成A。
11.(18分)要求写出必要的文字说明、化学方程式和重要的解题步聚,只写出最后答案的不能给分。
著名的“侯氏制碱法”的第一步反应是向饱和食盐水中通入CO2而析出NaHCO3,该反应可表示为:NH3 + NaCl + CO2 + H2O = NaHCO3↓+ NH4Cl
已知NaCl、NaHCO3、NH4Cl如下温度的溶解度:
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
今在40℃时,向434 g饱和食盐水中通入44.8 L(标准状况)NH3,再向溶液中通入过量的CO2,求:
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
理科综合能力测试(化学部分)参考答案及评分标准
Ⅰ卷 每小题6分,共48分
1.B 2.C 3.B 4.D 5.B 6.D 7.D 8.C
Ⅱ卷 包括3小题,共50分
9.(16分)
(1)Cl2,Na2CO3,盐酸 (每空2分)
(2)烧杯、玻璃棒 (4分)
(3)使溶液中的Ca2+形成CaCO3沉淀。 (3分)
过滤前先静置,取上层澄清溶液,滴加少量Na2CO3溶液,无沉淀产生(或滴加少量盐酸有气泡产生),说明Y溶液是足量的。 (3分)
10.(16分)
(1)Ca,碳 (每空2分)
(2)CaC2+2H2O→C2H2↑+Ca(OH)2 (4分)
(3)2CO2+2Na2O2=2Na2CO3+O2 (4分)
(4)B、F、H (4分)
11.(18分)
【解】根据40℃时NaCl的溶解度,可以计算出434 g食盐水中NaCl的质量和物质的量:![]() ,
,![]()
通入的NH3的物质的量:![]() (3分)
(3分)
由反应式NH3 + NaCl + CO2 + H2O = NaHCO3↓+ NH4Cl可知各反应物和生成物之间物质的量相等的关系。
所以,可生成NaHCO3的质量:m(NaHCO3)=2 mol×84 g·mol—1=168 g
溶液中剩余的水的质量为:![]()
这些水在40℃时可溶解NaHCO3的质量:![]()
(1)析出NaHCO3的质量为:m(NaHCO3)=168 g—36.5 g=131.5 g (4分)
(2)现有NH4Cl质量:m(NH4Cl)=2 mol×53.5 g·mol—1=107 g
40℃时,280.8 g水中可溶NH4Cl质量:
![]()
因为129.17 g >107 g,所以NH4Cl不能析出。 (4分)
(3)降温至10℃,可析出NH4Cl
![]() (4分)
(4分)
(4)降温至10℃时,NH4Cl溶液已饱和,可加入NaCl粉末,搅拌使之溶解,从而增加Cl—离子浓度,使NH4Cl的如下溶解平衡向左移动,则可析出更多的NH4Cl晶体。
![]() (3分)
(3分)