08届高三年级理科综合第三次月考试题
理科综合试卷
本试卷分第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷第1至5页,第Ⅱ卷6至13页。共300分,考试时间150分钟。
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、学号、考试科目涂写在答题卡上。考试结束,将答题卡交回。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号,不能答在试题卷上。
第Ⅰ卷
本卷共21小题,每小题6分,共126分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56 Cu 64
一、选择题(本题包括13小题。每小题只有一个选项符合题意)
1.如图,在图甲装置A与装置B中敞口培养相同数量的小球藻,以研究光照强度对小球藻产生氧气量的影响。装置A的曲线如图乙。据图分析,下列叙述正确的是( )
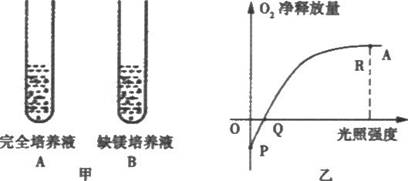
A.P点处能产生ATP的场所只有线粒体
B.适当降低温度,P点将下移
C.在图乙上绘制装置B的曲线,R点应下移
D.在图乙上绘制装置B的曲线,Q点应下移
2.下列说法中正确的有几种( )
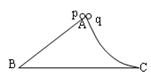
①线粒体中有等位基因,可控制生物的某些性状
②基因自由组合,如果F2的分离比分别为9∶7,9∶6∶1和15∶1,那么F1与纯隐性个体间进行测交,得到的分离比将分别为1∶3,1∶2∶1和3∶1
③在真核细胞中,基因转录的最初产物mRNA其长度要比可翻译的mRNA长度短得多
④在一条包含有若干基因的DNA分子中,各个基因具有转录功能的链都在同一条链上
⑤用基因枪可以实现基因的直接转移,所以可以用细胞或组织直接操作,不需要先游离原生质体
⑥无性生殖中的孢子生殖,其中的孢子不属于生殖细胞
A.一种 B.二种
C.三种 D.四种
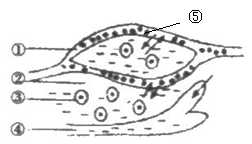 3.如图为人体细胞及其内环境之间物质交换的示意图,①②③④分别表示人体内不同部位的液体,⑤表示细胞。据图判断下面说法正确的是( )
3.如图为人体细胞及其内环境之间物质交换的示意图,①②③④分别表示人体内不同部位的液体,⑤表示细胞。据图判断下面说法正确的是( )
A.人体的内环境是由①②③组成的
B.体液①中含激素、血红蛋白、尿素、CO2等物质
C.效应B细胞分泌的抗体先进入②,再进入①④,经循环系统运输到发炎部位
D.⑤细胞呼吸作用的终产物是乳酸
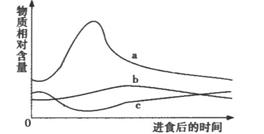 4.如图表示人进食后血液中胰岛素和胰高血糖素相对含量的变化,其中的两条曲线分别表示健康人两种激素的变化趋势,另一条曲线表示糖尿病人胰岛素的变化趋势。下列有关叙述,错误的是( )
4.如图表示人进食后血液中胰岛素和胰高血糖素相对含量的变化,其中的两条曲线分别表示健康人两种激素的变化趋势,另一条曲线表示糖尿病人胰岛素的变化趋势。下列有关叙述,错误的是( )
A.曲线b表示糖尿病人血液中胰岛素相对含量的变化趋势
B.在曲线c上升时,人体下丘脑还可通过有关神经的作用,促使肾上腺素的分泌
C.曲线a表示的激素是人体内唯一能降低血糖含量的激素
D.人体通过a、c激素的协同作用,可使血糖含量维持在相对稳定的水平
5.某同学用显微镜观察动物细胞时,发现视野右下方有一个细胞,其中含有8条大小、形态各不相同的染色体。欲将此细胞移到视野中央,并确定该细胞处于哪个时期。下列对装片操作及确定时期都正确的一组是( )
A.向右下方移、有丝分裂后期
B.向左上方移、减数第一次分裂期
C.向右下方移、减数第二次分裂期
D.向左上方移、有丝分裂末期
6.学习化学要求准确、规范使用化学术语。下列各组化学用语或物质名称中正确的是
A.在自然界中,金钢石的硬度最大
B.硫磺附在试管内壁,可以用二硫化碳或热强碱溶液洗涤
C.甲笨能使酸性高锰酸钾溶液褪色
D.乙酸乙脂在酸性条件下水解速率比碱性条件下的慢
7.据报道,科学家已成功合成了少量O4,有关O4的说法正确的是
A.O4的摩尔质量是64 g B.O4是O2的同分异构体
C.O4是O2的同素异形体 D.相同质量的O4和O2所含原子个数比为1∶2
8.用NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.46 g四氧化二氮和二氧化氮的混合物中含有的原子总数一定为3 NA
B.5.6 g铁粉与硝酸反应失去的电子数一定为0.2 NA
C.将1 mol FeCl3制成胶体分散系,其中分散质粒子数为NA
D.同温同压下,3 mol C2H2(g)和1 mol C6H6(g)的密度相等
9.近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(α—羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为HOOCCH(OH)CH2COOH,下列有关说法错误的是
A.苹果酸在一定条件下能发生催化氧化反应
B.苹果酸在一定条件下能发生酯化反应
C. 苹果酸在一定条件下能发生消去反应
D.1 mol 苹果酸与足量NaHCO3溶液反应肯定能产生44.8 L CO2气体
10.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.12 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.50 mL B.25 mL C.30 mL D.15 mL
11.下列依据热化学方程式得出的结论正确的是
A.已知:2C(s) + 2O2(g) == 2CO2(g);△H1 2C(s) + O2(g) == 2CO(g);△H2,
则△H1 > △H2
B.已知:2H2(g) + O2(g) == 2H2O(g);△H = − 438.6 kJ/mol 则氢气的燃烧热为241.8 kJ/mol
C.已知:NaOH(aq) + HCl(aq) == NaCl(aq) + H2O(l);△H = − 57.4 kJ/mol 则含20.0 gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D.已知:C(石墨,s) + O2(g) == CO2(g);△H = − 393.51 kJ/mol
C(金刚石,s) + O2(g) == CO2(g);△H = − 395.41 kJ/mol 则由石墨制备金刚石的反应是放热反应
12.相对分子质量为a的某种物质在室温下的溶解度为b g,此时测得饱和溶液的密度为c g/cm3,则该饱和溶液的物质的量浓度是
![]()
![]()
A. B.
![]()
![]()
C. D.
13.下列离子方程式正确的是
A.过量的CO2通入NaOH溶液中:CO2 + 2OH− == CO32− + H2O
B.将铝片投入NaOH溶液中:Al + 2OH− == AlO2− + H2↑
C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I− == 2Fe2+ + I2
D.将铜片投入到稀硝酸溶液中:3Cu + 8H+ + 2NO3− == 3Cu2+ + 4H2O + 2NO↑
二、选择题(本题包括8小题。每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分)
14.我国发射的神州五号载人宇宙飞船的周期约为90min,如果把它绕地球的运动看作是匀速圆周运动,飞船的运动和人造地球同步卫星的运动相比,下列判断中正确的是
A.飞船的轨道半径大于同步卫星的轨道半径
B.飞船的运行速度小于同步卫星的运行速度
C.飞船运动的向心加速度大于同步卫星运动的向心加速度
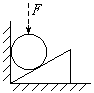 D.飞船运动的角速度小于同步卫星运动的角速度
D.飞船运动的角速度小于同步卫星运动的角速度
15、一光滑球夹在竖直墙与放在水平面上的楔形木块间,处于静止,若对光滑球施一个方向竖直向下的力F,如图所示,整个装置仍处于静止,则与施力F前相比较( )
A 水平面对楔形木块的弹力不变 B 水平面对楔形木块的摩擦力不变
 C 墙对球的弹力不变
D 楔形木块对球的弹力增大
C 墙对球的弹力不变
D 楔形木块对球的弹力增大
16.一个固定在水平面上的光滑物块,其左侧面是斜面AB,右侧面是曲面AC,如图5所示。已知AB和AC的长度相同。两个小球p、q同时从A点分别沿AB和AC由静止开始下滑,比较它们到达水平面所用的时间:
A.p小球先到 B.q小球先到 C.两小球同时到 D.无法确定
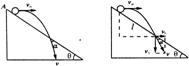 17.如图,从倾角为θ的足够长的斜面上的A点,先后将同一小球以不同的初速度水平向抛出,第一次初速度初速度为V1,球落到斜面前一瞬间的速度方向与斜面夹角为α1,第二次初速度为V2,球落到斜面上前一瞬间的速度方向与斜面的夹角为α2,若V1>V2,则( )
17.如图,从倾角为θ的足够长的斜面上的A点,先后将同一小球以不同的初速度水平向抛出,第一次初速度初速度为V1,球落到斜面前一瞬间的速度方向与斜面夹角为α1,第二次初速度为V2,球落到斜面上前一瞬间的速度方向与斜面的夹角为α2,若V1>V2,则( )
A.α1>α2 B.α1=α2
C.α1<α2 D.无法确定
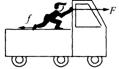 18.如图所示,站在汽车上的人用手推车的力为F,脚对车向后摩擦力为f,下列说法正确的是( )
18.如图所示,站在汽车上的人用手推车的力为F,脚对车向后摩擦力为f,下列说法正确的是( )
A.当车匀速运动时,F和f对车的合力为零
B.当车加速运动时,F和f对车的合力与车的位移相反
C.当车减速运动时,F和f对车的合力与车的位移相反
D.不管车做何种运动,F和f对车的合力都为零
19.一质量为m的带电液滴以竖直向下的初速度v0进入某电场中,由于电场力和重力的作用,液滴沿竖直方向下落一段距离h后,速度为零。以下判断正确的是
A.电场力对液滴做的功为![]() B.液滴克服电场力做的功为
B.液滴克服电场力做的功为![]()
 C.液滴的机械能减少mgh
D.电场力对液滴的冲量大小为mv0
C.液滴的机械能减少mgh
D.电场力对液滴的冲量大小为mv0
20.如图所示,质量为m的弹丸以速度v0水平向右射中质量为M的静止的单摆摆球,使其摆动,当摆球摆动经最低点时,又被另一颗完全相同的弹丸仍以对地速度v0向右击中.两次击中后弹丸均未穿出摆球.已知摆长为l,击中后单摆的运动可视为简谐振动,则第2次击中后可能出现的情况是:
A.由摆球(2m+M)组成的单摆静止;
B.摆球(2m+M)向右摆动,最大速度等于![]() ;
;
C.摆动幅度不可能增大;
D.从开始摆动到第2次击中时,单摆运动了![]() (n=1,2,3,…)
(n=1,2,3,…)
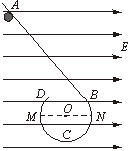 21.如图所示,在光滑、绝缘的水平桌面上固定放置一光滑、绝缘的挡板ABCD,AB段为直线挡板,BCD段是半径为R的圆弧挡板,挡板处于场强为E的匀强电场中,电场方向与圆直径MN平行。现有一带电量为q、质量为m的小球由静止从挡板内侧上的A点释放,并且小球能沿挡板内侧运动到D点抛出,则
21.如图所示,在光滑、绝缘的水平桌面上固定放置一光滑、绝缘的挡板ABCD,AB段为直线挡板,BCD段是半径为R的圆弧挡板,挡板处于场强为E的匀强电场中,电场方向与圆直径MN平行。现有一带电量为q、质量为m的小球由静止从挡板内侧上的A点释放,并且小球能沿挡板内侧运动到D点抛出,则
A.小球运动到N点时,挡板对小球的弹力可能为零
B.小球运动到N点时,挡板对小球的弹力可能为Eq
C.小球运动到M点时,挡板对小球的弹力可能为零
D.小球运动到C点时,挡板对小球的弹力一定大于mg
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
第II卷(非选择题 共174分)
物 理 答 卷
学号 班级 姓名 成绩
三.实验题(共18分,(1)题3分,(2)题3分,(3)题12分)
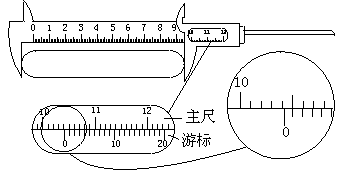 22.(1).有一游标卡尺,主尺的最小分度是1 mm,游标上有20个小的等分刻度.用它测量一工件的长度,如图所示.图示的读数
22.(1).有一游标卡尺,主尺的最小分度是1 mm,游标上有20个小的等分刻度.用它测量一工件的长度,如图所示.图示的读数
是 mm.
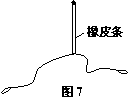 (2).在“验证力的平行四边形定则”实验中,需要将橡皮条的一端固定在水平木板上,另一端系有两根细绳,细绳的另一端都有绳套如图7所示.实验中需用两个弹簧秤分别勾住绳套,并互成角度地拉橡皮条.某同学认为在此过程中必须注意以下几项:
(2).在“验证力的平行四边形定则”实验中,需要将橡皮条的一端固定在水平木板上,另一端系有两根细绳,细绳的另一端都有绳套如图7所示.实验中需用两个弹簧秤分别勾住绳套,并互成角度地拉橡皮条.某同学认为在此过程中必须注意以下几项:
A.两根细绳必须等长.
B.橡皮条应与两绳夹角平分线在同一直线上.
C.在使用弹簧秤时要注意使弹秤与木板平面平行.
其中正确的是 .(填入相应的字母)
(3).一般情况下,金属导体的电阻会随着温度改变而改变。某同学为研究一小灯泡灯丝电阻与温度的关系,设计并完成了有关的实验。实验中用到了下列器材:待测小灯泡、15V直流稳压电源、滑动变阻器(最大阻值为30Ω,最大允许电流为1.0A)、电压表(量程0~15V,内阻约15kΩ)、电流表(量程0~0.6A,内阻约5Ω)、开关一只及导线若干。实验中调节滑动变阻器,小灯泡两端的电压可以从0V至额定电压范围内变化,从而测出小灯泡在不同电压下的电流,得到了下表中的实验数据:
| U/V | 0 | 0.75 | 1.38 | 1.80 | 2.30 | 3.2 | 4.3 |
| I/A | 0 | 0.04 | 0.07 | 0.09 | 0.12 | 0.15 | 0.18 |
| U/A | 5.0 | 6.1 | 7.2 | 8.3 | 10.3 | 12.0 | |
| I/A | 0.19 | 0.21 | 0.22 | 0.23 | 0.25 | 0.26 |
 ①请在框内画出为完成上述实验而设计的合理的电路图。
①请在框内画出为完成上述实验而设计的合理的电路图。
②通过所测的数据可知,小灯泡的电阻随其两端所加电
压的升高而 (选填“增大”、“保持不变”或“减小”)。
 23.(16分)右图为某报纸的一篇科技报道,你能发现其中的科学性问题吗?请通过必要的计算加以说明。下面的数据在你需要时可选用。
23.(16分)右图为某报纸的一篇科技报道,你能发现其中的科学性问题吗?请通过必要的计算加以说明。下面的数据在你需要时可选用。
引力常量G=6.7×10-11N·m2/kg2;地球表面重力加速度g=10m/s2;地球半径R=6.4×106m;地球自转周期T=8.6×104s;地球公转周期T'=3.2×107s。(π2=10;70~80的立方根约取4.2)
24.(18分)如图所示,直线ON与x轴正方向夹角为300,当第一象限中存在沿y轴负方向的匀强电场时,在y轴上A点处沿x轴正方向射入一个初速度V0的正离子,恰好垂直打在ON上的P点(P点未画出).将电场换成垂直于纸面向外的匀强磁场时,相同的正离子在y轴上的B点处以相同的初速度射人后,也恰好垂直ON打在P点.不计重力.
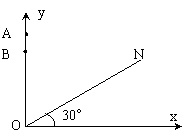 (1) 求OA:OB的值
(1) 求OA:OB的值
(2) 求电场强度E与磁感应强度B的比值
(3) 若A到P的时间为t1 若B到P的时间为t2,求t1:t2
25.(20分)竖直平面内的轨道ABCD由水平滑道AB与光滑的四分之一圆弧轨道CD组成,AB恰与圆弧CD在C点相切,轨道放在光滑水平面上,如图所示。一个质量为m的小物块(可视为质点)从轨道的A端以初动能E冲上水平滑道AB,沿着轨道运动,由DC弧滑下后停在水平滑道AB的中点。已知水平滑道AB长为L,轨道ABCD的质量为3m。求:
⑴小物块在水平滑道上受到的摩擦力的大小。
⑵为了保证小物块不从滑道的D端离开滑道,圆弧滑道的最小半径R是多大?
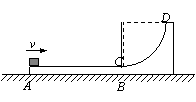 ⑶在(2)小问的基础上,若增大小物块的初动能,使得小物块冲上轨道后可以达到的最大高度是1.5R,试分析小物块最终能否停在滑道上?
⑶在(2)小问的基础上,若增大小物块的初动能,使得小物块冲上轨道后可以达到的最大高度是1.5R,试分析小物块最终能否停在滑道上?
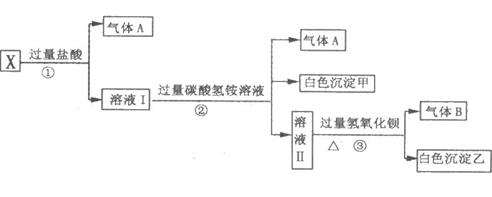 26.(14分)某无色溶液X,由SO42−、CO32−、AlO2−、MnO4−、Na+、Ba2+、Al3+、Ag+中的若干种离子组成,取溶液进行如下连续实验:
26.(14分)某无色溶液X,由SO42−、CO32−、AlO2−、MnO4−、Na+、Ba2+、Al3+、Ag+中的若干种离子组成,取溶液进行如下连续实验:
(1)气体A的成分是____________,气体B的成分是____________。
(2)X溶液中一定存在的离子是_______________________________。
(3)写出步骤①发生反应的所有离子方程式__________________________________________
_______________________________________________。
(4)写出步骤②形成白色沉淀甲的离子方程式_______________________________________。
(5)通过上述实验,溶液X中还未完全确定的离子是___________;只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是________________________________________
________________________________________________________________________。
27.(19分)Ⅰ.过氧化氢(H2O2)是一种无色黏稠液体,它的水溶液俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。
(1)H2O2的电子式为____________________,固态时H2O2为___________晶体(填晶体类型)。
(2) H2O2可看成是一种二元弱酸,请写出它的第二步电离方程式_______________________,
向H2O2溶液中加入过量Ba(OH)2溶液,反应的化学方程式为_________________________。
(3)将H2O2溶液加入到酸性FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式______________________________________________。
(4)某工厂废水中含有一定量氯气,为了除去氯气,常加入H2O2作脱氯剂,写出该反应的化学方程式________________________________________________。
Ⅱ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3− + 4 H+ + 3e − → NO + 2 H2O
KMnO4、Na2CO3、Cu、Fe2(SO4)3四种物质中的一种物质(X)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:
________________________________________________________________。
(2)反应中硝酸体现了____________、_____________性质。
(3)反应中若产生4.48 L气体(标准状况),则转移电子的物质的量是___________mol。
(4)若1 mol X与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
______________________________________________________________________。
28.(13分)酯B水解生成乙醇和羧酸A,酯B的相对分子质量为174,又知羧酸A的最简式的式量为59。取一定质量的羧酸A完全燃烧,生成的CO2和H2O的质量之比为88∶27。试回答下列问题:
(1)羧酸A分子中,C、H、O原子的个数比为_________________。
(2)羧酸A的分子式为__________________。
(3)酯B的分子式为____________________。
(4)酯B可能有的结构简式为______________________________________________。
(5)乙醇、浓硫酸在170℃条件下发生反应的化学方程式为:
_________________________________________,反应类型为______反应(填反应名称)。
29.(14分)肼(N2H4)又称联氨,常温下是一种可燃性液体,可用作火箭燃料。又知NH3与N2H4,NH4+与N2H62+的性质具有某些相似性。
(1)已知肼分子中每个原子均达到稀有气体元素原子的稳定结构,请写出肼分子的电子式____________________。
(2)已知在101kPa、25℃时,16.0 g肼在氧气中完全燃烧生成氮气和液态水,放出312 kJ的热量。请写出此燃烧反应的热化学方程式:
_______________________________________________________________________。
(3)写出N2H62+与足量NaOH溶液反应的离子方程式:
______________________________________________________________________。
(4)肼 — 空气燃料电池是一种碱性燃料电池,电解质溶液为20% ~ 30%的KOH溶液,请写出该电池放电时正极的电极反应式:_____________________________________。
(5)传统制备肼的方法是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式为:
_________________________________________________________________。
(6)肼(N2H4)与过氧化氢、乙烷的相对分子质量相近,且均为非金属氢化物,但乙烷与前两者沸点相差较大。其原因为_____________________________________________________
30.(20分) 下图为植物和高等动物(如人体)新陈代谢的过程示意图。分析回答:
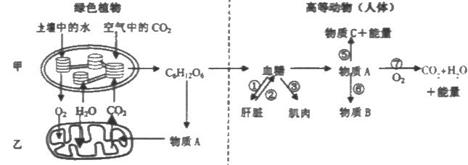
(1)在植物的叶肉细胞中,甲、乙两种细胞器都是重要的“能量转换器”,且两种结构的膜面积都很大,其中甲增加膜面积是通过 ,乙增加膜面积是通过 。
(2)在高温干旱的环境里,绿色植物从空气中吸收的CO2会减少,原因是
,若该植物为玉米,此种环境对其光合作用的影响并不是很大,原因是
。
(3)绿色植物通过甲所产生的糖类,由消化道进入人体并被组织细胞所利用,整个过程共穿过 层磷脂双分子层。
(4)发生在高等动物细胞结构乙中的生物过程是(填序号) ;在缺氧情况下,物质A可通过⑤过程形成物质C(填名称) ;物质A在肝脏内可以在谷丙转氨酶的作用下进行 作用,形成物质B(填名称) 。
(5)治疗糖尿病的激素类药物可以通过细胞工程生产。利用 技术,培养出细胞株、细胞系,获得蛋白质制品。细胞株与细胞系相比,根本区别在于后者
。
31. Ⅰ(10分) 病毒侵入人体后,机体会产生微量高效的干扰素,以抵抗病毒的攻击。下图是机体细胞产生干扰素以及干扰素发挥作用的示意图。请结合示意图回答下列问题:
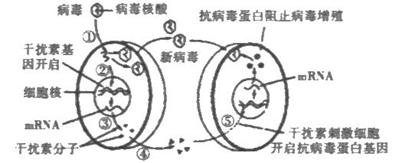
(1)图中产生干扰素的细胞最可能是人体内的 细胞,该细胞可由
增殖分化而来。
(2)图中阻止病毒增殖的物质是抗病毒蛋白质,而在人体内环境中阻止病毒播散的物质是 。
(3)现在已用基因工程方法生产干扰素。如果利用大肠杆菌来生产人的干扰素,那么目的基因是 ,最佳的运载体是 。
(4)乙肝和丙肝分别由乙肝病毒(HBV,DNA病毒)和丙肝病毒(HCV,RNA病毒)引起。干扰素对乙肝和丙肝均有一定的疗效。
①乙肝和丙肝均可能最终导致肝癌,这属于引起细胞癌变的 致癌因子。
②科学家发现干扰素对丙肝的疗效与患者本身某些基因的表达有一定关系。预测干扰素疗效的基因芯片(含有DNA分子探针)利用 原理,可以测试患者相关基因的表达状态,为选择干扰素最佳用药方法提供依据。
Ⅱ(12分)大肠杆菌是K12中的两个菌株A和B,菌株A需要在基本培养基上补充甲硫氨酸和生物素,菌株B需要在基本培养基上补充苏氨酸、亮氨酸和硫胺。菌株A与B在基本培养基上都不能生长,因此把它们分别涂布在基本培养基的固体平板上,培养几天后,都没有看到任何菌落,若是把A与B混合培养在不含有上述五种物质的液体培养基中几小时后,离心培养物,把沉淀的细胞洗涤后涂布在基本培养基上发现长出了菌落,频率是1/107。
对此可做出三种可能假设:
①
②
 ③营养物质上的互补,即一些物质从一菌株的细胞中泄露出来而为另一菌株的细胞所吸收利用。
③营养物质上的互补,即一些物质从一菌株的细胞中泄露出来而为另一菌株的细胞所吸收利用。
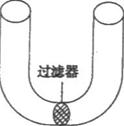
(2)为了证明上述假设,设计一种U型管(如图),中间有过滤器隔开,滤器的孔很小,细菌不能通过,但培养液和营养物质可以通过。请完成以下实验步骤:
步骤一:
步骤二:
步骤三:
结果预测:
结论:菌株A和菌株B不可能通过营养互补产生菌落。
推想:菌株A和菌株B的细菌通过接触后,可能少数细菌就像高等生物的有性生殖过程一样,产生了杂交,遗传物质有了交换,产生了与两个亲本不同的基因型。
生物:
1、C 2、B 3、D 4、D 5、C
30.(1)类囊体(囊状结构)的垛叠 内膜向内腔折叠形成嵴
(2)为了防止水分的过度丧失,气孔关闭,通过气孔进入叶片的CO2减少 玉米为C4植物,具有C4途径,能够利用低密度的CO2进行光合作用
(3)7
(4)⑦ 乳酸 氨基转化 丙氨酸
(5)动物细胞培养 遗传物质发生改变
31.Ⅰ(1)效应T细胞 T淋巴细胞或记忆细胞
(2)抗体
(3)人的干扰素基因 大肠杆菌的质粒
(4)①病毒 ②DNA分子与RNA分子杂交
Ⅱ(1)发生了基因突变
②不同细菌间遗传物质发生了交换(或基因重组)
(2)步骤一:向U型管中加入液体基本培养基
步骤二:向U型管一侧加菌株A,另一侧加菌株B,培养一段时间
步骤三:将U型管两端的细菌各自取出洗涤后,分别涂布在基本培养基的固体平板上观察其数量和存活状态
结果预测:没有发现任何新细菌或菌落产生
化学:
6.B 7.C 8.A 9.D 10.A 11.C 12.B 13.D
26.(14分) (1)CO2(1分) NH3(1分) (2)Na+、AlO2−、CO32−(各1分,共3分)
(3) CO32− + 2H+ == CO2↑ + H2O(2分) AlO2− + 4H+ == Al3+ + 2H2O(2分)
(4)Al3+ + 3HCO3− == Al(OH)3↓+ 3CO2↑(2分)
(5)SO42−(1分) 在沉淀乙中加入稀盐酸,若白色沉淀能完全溶解,则溶液X中不存在SO42−;若不能完全溶解,则存在SO42−离子(2分)
![]()
![]() 27.(19分)Ⅰ.(1)
(2分) 分子(1分)
27.(19分)Ⅰ.(1)
(2分) 分子(1分)
(2)HO2− H+ + O22−(2分) Ba(OH)2 + H2O2 == BaO2 + 2H2O(2分)
(3)2Fe2+ + 2H+ + H2O2 == 2Fe3+ + 2H2O(2分)
(4)Cl2 + H2O2 == 2HCl + O2(或写成Cl2 + H2O2 == 2HClO也可)(2分)
Ⅱ.(1)3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑ + 4H2O(2分) (2)酸性(1分)、氧化性(1分)
(3)0.6(2分) (4)使用了较浓的硝酸,产物中有部分NO2生成(2分)
28.(13分)(1)2∶3∶2 (2分) (2)C4H6O4(2分) (3)C8H14O4(2分)
(4)CH3CH2OOCCH2CH2COOCH2CH3(2分) CH3CH2OOCCH(CH3)COOCH2CH3(2分)
![]()
![]()
![]() (5)C2H5OH
CH2=CH2↑+H2O(2分) 消去(2分)
(5)C2H5OH
CH2=CH2↑+H2O(2分) 消去(2分)
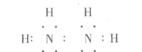
29.(14分) (1) (2分)
(2)N2H4(l) + O2(g) == N2(g) + 2H2O(l);△H = − 624 kJ/mol (2分)
(3)N2H62+ + 2OH− == N2H4 + 2H2O (2分)
(4)O2 + 2H2O + 4e− == 4OH− (3分)
(5)ClO− + 2NH3 == N2H4 + Cl− + H2O (3分)
(6)肼、过氧化氢分子间能形成氢键,沸点升高 (2分)
物理卷答案:
14 C 15 D 16 B 17 B 18 AB 19 B 20 ABD 21 C
22.(1)104.05mm (2)C (3)① 外接分压 ②增大
23.解:本报道中,地球同步卫星高度735公里的数据出错,以下的计算可以说明。-----2分
在地球同步轨道上,卫星受地球的万有引力提供卫星绕地球运转所需的向心力。设卫星的质量为m,离地面高度为h,有:![]() -------------4分
-------------4分
在地球表面上,质量为![]() 的物体,受地球的万有引力等于物体的重力,有:
的物体,受地球的万有引力等于物体的重力,有:![]() 得
得 ![]() ---------------------4分
---------------------4分
由此可得 ![]() ---------------------3分
---------------------3分
代入数据得![]() (能说明差2个数量级即可)------3分
(能说明差2个数量级即可)------3分
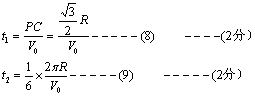
24、(18分)解:(1)如图,设粒子作匀速圆周运动的半径为R.
由几何关系知: PC=![]() CO=R/2
CO=R/2
A—P作类平抛运动,设竖直方向的加速度为a
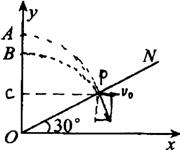
![]() -------(1) ---------1分
-------(1) ---------1分
![]() --------(2) --------1分
--------(2) --------1分
![]() ------2分
------2分
![]() -------2分
-------2分
(2) B—P作匀速圆周运动,洛仑兹力提供向心力,
![]()
![]()
![]() -----------2分
-----------2分
由牛顿第二定律有:![]() 代入(3)得
代入(3)得![]() ----------2分
----------2分
![]() ------------------2分
------------------2分
(3) 
![]()
25.解:(1)整个系统水平方向合外力为零,所以水平方向动量守恒,设系统最终速度为v
有 ![]() ---------------2分
---------------2分
![]() ---------------2分
---------------2分
有能量的转化关系有
![]() --------------2分
--------------2分
由以上各式解得:![]() ---------------2分
---------------2分
(2)设滑块恰能滑至最高点,滑块和轨道的速度相同,系统水平方向动量守恒。
有能量转化关系有:![]() ---------------2分
---------------2分
解得:![]() ---------------2分
---------------2分
(3)滑块滑离轨道最高点后,滑块和轨道的水平速度相同,依然能返回轨道中,假设能停留在水平轨道上离B点距离为s处,系统水平方向动量守恒。
![]() ---------------2分
---------------2分
由能量转化关系有:
在最高点处有:![]() ---------------2分
---------------2分
在水平轨道上有:![]() ---------------2分
---------------2分
由以上式子解得:![]() S=0.75L
---------------2分
S=0.75L
---------------2分
所以滑块能停在AB上,距B为0.75L处。