高三年级月考(七)理综卷
理科综合试题
时量;120分钟 满分:150分
可用到用的相对原子质量:H—1 O—16 C—12 Cu—64
第Ⅰ卷(选择题 共126分)
一、选择题(本题包括13小题,每题6分,共计78分。每小题只有一个选项符合题意)
1.下列物质一定不能作为生物的能源物质的是 ( )
A.生长因子 B.无机碳源 C.无机氮源 D.ATP
2.下列哪个过程从根本上为自然选择提供了原材料 ( )
A.DNA→DNA B.DNA→RNA
C.mRNA→蛋白质 D.转运RNA携带氨基酸
3.对根瘤菌的叙述,不正确的是 ( )
A.它的增殖方式为二分裂 B.它的细胞内无染色体
C.它的代谢类型是异养需氧型 D.在生态系统中它属于分解者
4.在真核生物细胞中,下列过程一定不或不一定在生物膜结构上进行的一组是 ( )
①氧气的生成 ②NADPH变为NADP+
③ADP转变为ATP ④光能转变为电能
⑤DNA复制和转录 ⑥抗体的合成
⑦构成细胞板的物质的合成 ⑧NADP+变为NADPH
⑨星射线或纺锤丝的形成
|
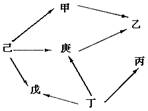
5.右图是某生态系统的食物网示意图,甲——庚代表
不同的生物。箭头表示能量流动的方向和食物联系。
下列叙述正确的是 ( )
A.此食物网只能反映捕食这一种种间关系
B.图中涉及的生物的总和构成生物群落
C.流经该生态系统的总能量是己所固定的太阳能总量
D.如某物种辛迁入该生态系统,可能破坏该生态系统多样性
6.下列物质中,既有离子键,又有共价键,且是非极性共价键的是 ( )
A.H2SO4 B.Na2O2 C.CaCO3 D.NH4Cl
7.NA为阿伏加德罗常数,下列叙述不正确的是 ( )
①1 mol甲基含有10 NA个电子
②a mol Cl2与足量烧碱溶液完全反应转移的电子数为2a NA
③1 mol O2在反应中作氧化剂时,所得电子数一定为4NA
④1 mol FeCl3完全转化成Fe(OH)3胶体,便有NA个Fe(OH)3胶粒
⑤一定条件下,1 mol N2与足量H2反应,可生成2 NA个NH3分子
A.②④ B.①③⑤ C.①②④ D.①②③④⑤
8.下列离子方程式书写正确的是 ( )
A.鸡蛋壳在醋酸溶液中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑
B.用电石与饱和食盐水反应制取乙炔:CaC2+2H2O Ca2++2OH—+C2H2↑
C.偏铝酸钠溶液中加入少量盐酸:H++AlO2—+H2O Al(OH)3↓
D.氯气与水反应:Cl2+H2O 2H++Cl—+ClO—
9.在给定的四种溶液中,以下各组离子可能大量共存的是 ( )
A.滴加石蕊试液显红色的溶液:K+、Ag+、NO3—、F—
B.pH值为3的溶液:Al3+、Na+、SO42—、Br—
C.水电离出来的c(H+)=10—13mol/L的溶液:Na+、Mg2+、NO3—、ClO—
D.所含溶质的NaNO3的溶液:H+、Fe2+、Cl—、SO42—
10.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32—)、c(HCO3—)都减少,其方法是( )
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
11.两种电解装置:①以铜为电极对Na2SO4溶液进行电解 ②以铂为电极对Na2SO4溶液进行电解当两装置中产生的氢气质量相同,两装置消耗的水的质量之比为 ( )
A.1:1 B.2:1
C.1:2 D.有一装置不消耗水,无法比较
12.下列电极反应中,既可能是原电池中的电极反应,又可能是电解槽中的电极反应的是
( )
A.2H++2e— H2↑ B.H2-2e—=2H+
C.O2+4e—+2H2O=4OH— D.4OH—-4e—=O2↑+2H2O
13.某烃的衍生物含碳40%,该有机物的相对分子质量必定是下列数值中某一数值的n倍(n倍为正整数),该数值是 ( )
A.20 B.30 C.40 D.50
二、选择题(本题包括8小题,每题6分,共计48分。有的小题只有一个正确选项,有的小题有多个选项,全部选对的得满分,选不全得一半分数,有选错或不答得0分)
|
A.当车匀速运动时,F和f对车做功的代数和为零
B.当车水平向右加速运动时,F和f对车做功的代数和为负功
C.当车水平向右减速运动时,F和f对车做功的代数和负功
D.不管车做何种运动,F和f的总功以及总功率都为零
15.两个物体在光滑的水平面上发生正碰,以下说法一定正确的是 ( )
A.质量大的物质的动量变化小
B.两个物体动量的变化大小相等,方向相反
|
| |
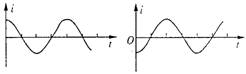
16.处在匀强磁场中的矩形线圈abcd,以恒定的角速度绕ab边
转动,磁场方向平行于纸面并与ab垂直。在t=0时刻,线
圈平面与纸面重合(如图),线圈的cd边离开纸面向外运动。
若规定由a→b→c→d→a方向的感应电流为正,则能反映线
圈中感应电流i随时间t变化的图线是 ( )
|
|
A. B. C. D.
17.一质为m的带电液滴以竖直向下的初速度v0进入某电场中,由于电场力和重力的作用,液滴沿竖直方向下落一段距离h后,速度为零,下列判断正确的是 ( )
A.电场力对液滴做的功为![]() B.液滴克服电场力做的功为
B.液滴克服电场力做的功为![]()
C.液滴的重力势能减少mgh D.液滴所受合外力的冲量大小为mv0
|
A.场强方向一定向左,且电势![]()
B.场强方向一定向左,且电势![]()
C.场强方向一定向右,且电势![]()
D.由于不知是从a运动到b,还是从b运动到a,所以无法判断
19.分别以P、V、T表示气体的压强、体积、温度。一定质量的理想气体,其初始状态表为(P0、V0、T0)。若分别经历如下两种变化过程:
①从(P0、V0、T0)变为(P1、V1、T1)的过程中,温度保持不变(T1=T0);
②从(P0、V0、T0)变为(P2、V20、T2)的过程中,既不吸热,也不放热。
在上述两种变化过程中,如果V1=V2>V0,则 ( )
A.P1>P2, T1>T2 B.P1>P2, T1<T2 C.P1<P2, T1<T2 D.P1<P2, T1>T2
|
A.这列波的彼为20m
B.这列波的频率为0.125 Hz
C.这列波的波速为25 m/s
D.这列波是沿x轴的正方向传播的
21.如图所示,质量为M,半径为R的四分之一圆弧状木块,放在光滑的水平面,其中PQ段水平。一个质量为m的小球从最高点开始自由滑下,不考虑一切摩擦,以下结论不正确的是 ( )
|
B.小球达到P点时,木块的速度为![]()
C.在PQ段小球对木块的压力大于mg
D.在PQ段小球、木块均做匀速运动
第Ⅱ卷(非选择题 共174分)
三、非选择题(本题包括10小题,共174分)
22.(17分)(1)两实验小组使用相同规格的元件,按右图电路进行测量。他们将滑动变阻器的滑片P分别置于a、b、c、d、e五个间距相同的位置(a、e为滑动变阻器的两个端点),把相应的电流表示数记录在表一、表二中,对比两组数据,发现电流表示数的变化趋势不同。经检查,发现其中一个实验组使用的滑动变阻器发生断路。
①滑动变阻器发生断路的是第 实验组;断路发生在滑动变阻器 段。
|
| ||||||||
| P的位置 | a | b | c | d | e | |||
| A的示数(A) | 0.84 | 0.48 | 0.42 | 0.48 | 0.84 | |||
| 表二(第二实验组) | ||||||||
| P的位置 | a | b | c | d | X | e | ||
| A的示数(A) | 0.84 | 0.42 | 0.28 | 0.21 | 0.84 | |||
②表二中,对应滑片P在X(d、e之间的某一点)处的电流表示数的可能值为:
A.0.16A B.0.26A C.0.36A D.0.46A
|
A.线圈A向上移动滑动变阻器滑动端P向右加速滑动,都能引起电流计指针向左偏转
B.线圈A中铁芯向上拔出或断开开关,都能引起电流计指针向右偏转
C.滑动变阻器的滑动端P匀速向左或匀速向右滑动,都能使电流计指针静止在中央
D.因为线圈A、线圈B的绕线方向未知,故无法判断电流计指针偏转的方向
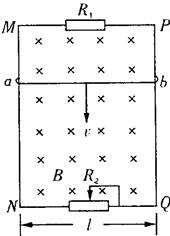
23.(16分)如图中MN和PQ为竖直方向的两平行长直金属导轨,间距l为0.40m,电阻不
|
24.(19分)一个带正电的微粒,从A点射入水平方向的匀强电场中,微粒沿直线AB运动,如图,AB与电场线夹角θ=30°,已知带电微粒的质量m=1.0×10—7kg,电量q=1.0×10—10C,A、B相距L=20cm。(取g=10m/s2,结果保留二位有效数字)求:
(1)说明微粒在电场中运动的性质,要求说明理由。
(2)电场强度的大小和方向?
(3)要使微粒从A点运动到B点,微粒射入电场时的最小速度是多少?
|
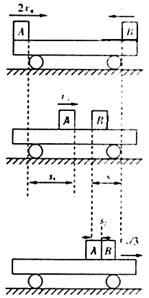
25.(20分)如图所示,一平板小车放在光滑水平面上,今有质量均为m的物体A和B分别以2v0和v0的初速度沿同一直线从小车两端同时相向水平滑上小车,两物体和小车的动摩擦因均为μ,小车的质量也为m。
(1)两物体不相碰,最后相对于小车静止,此时小车速度多大?此过程中摩擦力产生的内能Q为多少?
(2)为了使两物体不相碰,小车的长度至少为多少?
(3)由开始滑上小车,到两物体都刚相对静止在车上时,物体B通过的位移为多大?
|
26.(18分)
Ⅰ.(8分)用石墨作电极,电解1mol/L下列物质的溶液,回答下列问题:
A.HCl B.NaOH C.Na2SO4 D.NaCl E.AgNO3
(1)溶液的pH值保持不变的是 ;
(2)电解时两极产生气体体积相等的是 ;
(3)电解时氧化产物与还原产物的物质的量之比为1:2的是 ;
(4)停止电解后,加一定量的水能使溶液恢复到通电前浓度的是 。
Ⅱ.(10分)下列物质在一定条件下发生如图所示的转化关系,其中A、B、C为中学化学中常见元素的化合物,甲、乙、丙为单质。
|
(1)若A在常温下是气体,甲中所含元素的原子共有3个电子层,且最外层电子数是次外层电子数的1/4,则C的化学式是 ;甲与A反应的化学方程式是
。
(2)若乙在常温下是液态,则C的化学式是 ,丙的化学式是 ,
写出A与甲反应生成B和乙的离子方程式
。
|
的装置:
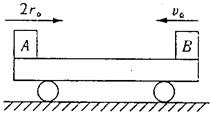
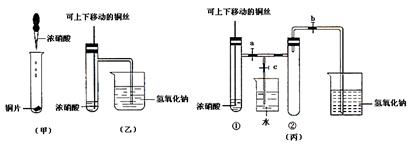
(1)写出铜和浓硝酸反应的化学方程式 。
(2)和甲装置相比,乙装置的两个优点是 。
(3)为了进一步验证NO2和水反应,某学生设计了丙装置。先关闭弹簧夹 ,再打开弹簧夹 ,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应先关闭 ,再关闭 ,然后打开 ,并对试管 (填编号)稍加热。
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是
(气体按标准状况计算)。
|
| |
(1)写出有关物质的结构简式
A. ,D. ,I.
(2)表中涉及到的有机反应类型有:取代、加成,水解,氧化、还原、消去和
;
(3)表中作B和C为同分异构体外,还有哪些分子互为同分异构体 ;
(4)写出F转化为D的化学反应方程式
。
|
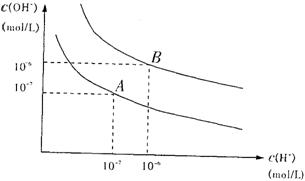
(1)若以A点表示25℃纯水的电离平衡时的离子浓度,当温度升高到100℃时,纯水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水质离子积增大的原因是
。
(2)已知:25℃时,0.1mol/L的HR溶液的pH<1,则H2R在水溶液中的电离方程式为
。
(3)100℃时,若将pH=9的NaOH溶液与pH=4的稀硫酸溶液混合,所得混合液pH=7,则NaOH溶液与稀硫酸溶液的体积比为 。
(4)100℃时,若10体积的pH=a某强酸溶液与1体积的pH=b某强碱溶液混合后溶液呈中性,则混合之前强酸溶液与强碱溶液的pH之间满足的关系是 。
|
别代表需要的三种酶)。
(1)人体内环境中的酪氨酸除图中
所示的来源外,还可以来自于
和 。
(2)合成酶①所需的基因与人体肠道
内寄生细菌的基因结构相比,主
要特点是 。
|
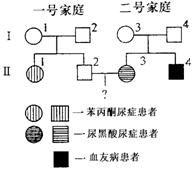
(4)某家系中(如右图),Ⅱ—1患有苯丙酮
尿症,Ⅱ—3患有尿黑酸尿症,Ⅱ—4不
幸患血友病(上述三种性状的等位基因分
别用Pp、Aa、Hh表示)。一号和二号家庭
均不携带对方家庭出现的遗传病基因。
①Ⅰ—3个体涉及上述三种性状的基因型是
。
②请以遗传图解的形式,解释一号家庭生育出患有苯丙酮尿症孩子的原因。
(5)Ⅱ—3已经怀有身孕,如果她生育一个女孩,健康的概率是1;如果生育一个男孩,健康的概率是 。
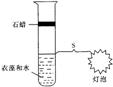
31.(22分)为检测光质(不同波长的光)对衣藻光合作用强度的影响,现提供如下的材料:
红、绿、白3种颜色的40W灯泡数个,试管数只、足量衣藻、pH试纸、石蜡油、NaHCO3溶液。请你完成下图的实验设计并回答有关问题:
实验开始步骤为:按右图所示组装好实验装置,放在20℃的环境中进行实验。
|
(2)请预测并简要分析上述实验结果:
。
(3)在不改变实验方法和材料的情况下要提高实验效果就应 。
参考答案
一、选择题(本题包括13小题,每题6分,共计78分。每小题只有一个选项符合题意)
二、选择题(本题包括8个小题,每题6分,共计48分。有的小题只有一个正确选项,有的小题有多个选项,全部选对的得满分,选不全得一半分数,有选错或不答得0分)
1.B 2.A 3.D 4.D 5.D 6.B 7.D 8.C 9.B 10.D 11.B 12.A 13.B 14.AB 15.B 16.C 17.BCD 18.C 19.A 20.AB 21.C
三、非选择题(本题包括10小题,共174分)
22.(1)①二 d—e ②D (2)B
23.解:由能量守恒,有![]()
代入数据解得 ![]()
又E=BLv
设电阻R1与R2的并联电阻为R并,ab棒的电阻为r,有
![]()
代入数据解得 R2=6.0Ω
24.解:(1)微粒只在重力和电场力作用下沿AB方向运动,在垂直于AB方向上的重力和电场力必等大反向,可知电场力的方向水平向左,如图所示。微粒所受合力的方向由B指向A,与初速度vA方向相反,微粒做匀减速运动。
(2)在垂直于AB方向上,有![]() ,所以电场强度E=1.7×104N/C电场强度的方向水平向左。
,所以电场强度E=1.7×104N/C电场强度的方向水平向左。
(3)微粒由A运动到B时的速度![]() 时,微粒进入电场时的速度最小,由动能定理得,
时,微粒进入电场时的速度最小,由动能定理得,![]() 代入数据,解得vA=2.8m/s
代入数据,解得vA=2.8m/s
25.解:(1)从开始运动到三者相对静止,系统动量守恒,以向右为正。
![]()
对系统由功能关系有 ![]()
将
![]() 代入,有
代入,有![]()
|
而![]()
∴![]()
(3)开始阶段小车所受的力中水平方向的力FA、FB,
等大以向,故小车静止,某时刻先有vB=0,此时v=0,
此阶段B向左运动的位移为sB,对B由动能定理有:
![]()
此后A继续向右运动,车和B保持相对静止一起向右运
动,直到相对静止,车和B向右的位移为s2,
对车和B由动能定理: ![]()
由前面![]() ∴B的位移大小为s=s1-s2=
∴B的位移大小为s=s1-s2=![]()
|
Ⅱ(1)CO Mg+CO2 2MgO+2C
(2)FeBr2
Fe 2Fe3++4Br—+3Cl2 2Fe2++6Cl—+2Br2
27.(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(2)①可以控制反应。②吸收NO2气体,防止污染环境
(3)c a、b
(4)b a c ②
(5)1/22..4mol·L—1或0.045mol·L—1
28.(1)CH3CH2CH3 CH2=CHCH3 CH3CH2COOCH2CH2CH3
(2)聚合反应(加聚或缩聚反应)
|
![]() (4)CH3CHOHCH3 CH2
(4)CH3CHOHCH3 CH2 CHCH4↑+H2O
29.(1)10—14 10—12 水的电离是吸的,升高温度,平衡向吸热即电离方向移动。(水的电离程度增大,离子浓度增大,故离子积增大)
![]() (2)HR
H++R—
(2)HR
H++R—
(3)1:9
(4)a+b=13
30.(1)食物 自身蛋白质的分解
(2)该基因的编码区是间断的、不连续的,有外显子和内含子。
(3)① ③
(4)①PPAaXHXb
|
(5)0.70
31.(1)将3只相同的试管编号,分别放入等量的衣藻,并加上等量的NaHCO3溶液。
再将红、绿、白3种颜色的灯泡在距试管相等的位置照射相同的时间,用pH试纸检测溶液pH的变化。
(2)衣藻在不同种光照下光合强度不同,CO2吸收量不同,试管内pH不同。在绿光下光合作用最弱,而呼吸作用的强度与其他试管的衣藻基本相同,这样就有更多的CO2溶于水生成碳酸,使pH最低;红光下稍高;白光下最高。
(3)适当提高温度