株洲市第二次高考模拟考试
理科综合
本试题分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分300分。考试时间150分钟。
第Ⅰ卷(选择题,共120分)
本卷共20题,每题6分,共120分。在下列各题的四个选项中,只有一个选项是符合题目要求的,请将正确选项的代号填入第Ⅱ卷卷首表格相应的空格中。
1.2001年9月日本政府正式宣布发现了亚洲首例“疯牛病”,世界上首例疯牛病是1996年在英国发现的并由此蔓延,研究表明人类的克罗伊茨费尔特——雅各布病(VCJD)与疯牛病一样,病原体(朊病毒)是一个能致病的蛋白质,而不含核酸,美国生物学家普鲁幸纳就是由于研究朊病毒做出的卓越贡献,而获得1997年诺贝尔医学生理奖。朊病毒有两种构象:正常型(PrPC)和致病型(PrPSC),PrPSC可胁迫PrPC转化为PrPSC,实现自我复制,并产生病理效应。下列有关疯牛病及朊病毒的叙述中错误的是( )
A.禁止将哺乳动物的蛋白质(如骨粉等)用作动物饲料,可有效预防“疯牛病”的传播
B.朊病毒的发现从理论上讲是对中心法则的补充和完善
C.朊病毒是通过细胞分裂的方式来繁殖的
D.要杀灭医疗器械上朊病毒,可用NaOH溶液浸泡
2.荣获2001年诺贝尔生理学奖的3位科学家研究发现了调节所有真核细胞周期的关键因子。其中美国的利兰·哈特韦尔发现了对各个细胞周期的最初阶段起调控作用的“START”基因,请在下图中指出“START”基因起作用的时期。
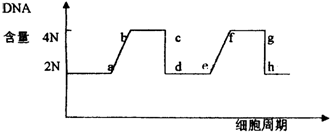
A.ab B.Fg C.de D.gh
3.采用黑—白瓶(不透光—可透光瓶)法测定池塘群落各深度日代谢的氧浓度变化,结果如下表,其中分析正确的是( )
| 深度 | 瓶中O2的变化/g·(m3)-1 | |
| 白瓶 | 黑瓶 | |
| 1m | +3 | -1 |
| 2m | +2 | -1 |
| 3m | 0 | -1 |
| 4m | -1 | -1 |
| 水底 | -3 | -3 |
A.该池塘3m水深处一昼夜生产的氧为1g·(m3)-1,耗氧量为1g·(m3)-1
B.该生态系统的光合量小于呼吸量,生物量不断减少
C.该群落在结构上,自养生物分布在3m以内的水深处
D.在该群落中,完全由异养生物组成的群落只分布在水底
4.一森林生态系统中有甲、乙两种昆虫,原来这两种昆虫密度长期在一定幅度中波动,保持动态平衡。后来在时间T点,对森林施放了一种邻近林区曾多次使用的化学杀虫剂,这一生态系统就发生了变化(如图)。下列说法正确的是( )

A.甲昆虫是肉食性昆虫
B.乙昆虫是植食性昆虫
C.邻近林区存在甲昆虫
D.邻近林区存在乙昆虫
5.世界卫生组织(WHO)将ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜,饮料水消毒方面有着广泛的应用。下列说法不正确的是( )
A.ClO2是强氧化剂 B.ClO2消毒能力比Cl2强
C.ClO2是共价化合物 D.ClO2分子中氯为-1价
6.下列具有特殊陛能的材料中,由主族元素和副族元素形成的化合物是( )
A.超导材料K3C60 B.透明陶瓷材料硒化锌
C.吸氢材料镧镍合金 D.半导体材料砷化镓
7.在下列各组反应中,两者反应遵循的化学原理相同的是( )
①KClO3+6HCl![]() KCl+3Cl2↑+3H2O和2Na2S+3H2SO3
KCl+3Cl2↑+3H2O和2Na2S+3H2SO3![]() 2Na2SO3+3S↓+3H2O
2Na2SO3+3S↓+3H2O
②FeCl3溶液中加入HI溶液和FeCl3溶液中加入苯酚溶液
③过氧化钠的漂白性和SO2水溶液的漂白性
④FeCl3用于净水和明矾净水
A.①③ B.②④ C.②③ D.①④
8.为了解决污染和能源上的重大问题,有些化学家提出了一些化学反应步骤,如:
①CaBr2+H2O![]() CaO+2HBr
②2HBr+Hg
CaO+2HBr
②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+CaO![]() HgO+CaBr2 ④HgO
HgO+CaBr2 ④HgO![]() Hg+
Hg+![]() O2↑
O2↑
但这些设想如何进一步操作尚未解决。这些联合反应的目的是为了制备( )
A.HBr B.H2 C.O2 D.Hg
9.新兴的大脑营养学研究发现,大脑的生长发育与不饱和脂肪酸有密切的关系,从深海鱼油中提取的被称作“脑黄金”的DH就是一种不饱和度很高的脂肪酸,它的分子中含有六个碳碳双键,学名为二十六碳六烯酸,它的分子式应是( )
A.C25H50COOH B.C25H39COOH C.C26H41COOH D.C26H47COOH
10.在同一温度下,某弱电解质溶液a,强电解质溶液b,金属导体c的导电能力相同,当升高温度后,它们的导电能力将是( )
A.a>b>c B.a=b=c C.c>a>b D.b>a>c
11.下列反应的离子方程式正确的是( )
A.偏铝酸钠溶液通入少量SO2气体:![]() +SO2+3H2O
+SO2+3H2O![]() 2Al(OH)3↓+
2Al(OH)3↓+![]()
B.硫酸亚铁溶液中加入次氯酸钠溶液:Fe2+2ClO-+2H2O![]() Fe(OH)2↓+2HClO
Fe(OH)2↓+2HClO
C.用氨水吸收过量的二氧化碳气体:2NH3·H2O+CO2![]() 2NH4+
2NH4+![]()
D.硫酸铵溶液中加入氢氧氧化钡溶液:![]() +
+![]() +Ba2+OH-
+Ba2+OH-![]() BaSO4↓+NH3·H2O
BaSO4↓+NH3·H2O
12.分别在PH=1的一元酸和PH=13的NaOH溶液中加入足量的铝,放出H2的量前者多。下列判断中正确的是:①两溶液体积相同时,酸是强酸;②两溶液体积相同时,酸则是弱酸;③酸溶液的体积一定大于NaOH溶液的体积;④酸是弱酸时,物质的量浓度比NaOH溶液的大。
A.②③ B.①④ C.①③ D.②④
13.下列说法中错误的是( )
A.天然放射现象说明原子核内部具有复杂结构
B.α粒子散射实验说明原子核是由质子和中子组成的
C.首先发现质子的核反应方程是:![]() N+
N+![]() He→
He→![]() O+
O+![]() H
H
D.氢原子从定态n=3跃迁到n=2,再跃迁到n=1定态,则最后一次跃迁辐射出的光子波长比前一次的短
14.一定质量的理想气体,在经历如图所示的状态变化过程中:

A.气体的内能变小
B.气体分子的平均距离增大
C.气体不断放热
D.每一个气体分子的动能都在增大
15.如图所示,实线为一列向右传播的横波在t=0时的波形,而虚线则为此列横波在t=0.5秒时的波形。若此列横波的周期为T,且0.3秒<T<0.5秒,则此列横波的波速为( )

A.34m/s
B.26m/s
C.18m/s
D.10m/s
16.光子有能量,也有动量,动量P=h/λ,它也遵守有关动量的规律。如图所示,真空中,有—“![]() ”字形装置可绕通过横杆中点的竖直轴OO′在水平面内灵活地转动,其中左边是圆形黑纸片(吸收光子),右边是和左边大小、质量相同的圆形白纸片(反射光子)。当用平行白光垂直照射这两个圆面时,关于装置开始时转动情况(俯视)的下列说法中正确的是( )
”字形装置可绕通过横杆中点的竖直轴OO′在水平面内灵活地转动,其中左边是圆形黑纸片(吸收光子),右边是和左边大小、质量相同的圆形白纸片(反射光子)。当用平行白光垂直照射这两个圆面时,关于装置开始时转动情况(俯视)的下列说法中正确的是( )

A.顺时针方向转动 B.逆时针方向转动
C.都有可能 D.不会转动
17.有一摆长为L的单摆,悬点正下方某处有一小钉,当摆球经过平衡位置向左摆动时,摆线的上部将被挡住,使摆长发生变化。现使摆球作小角度摆动,图示为摆球从右边最高点M摆至左边最高点N的闪光照片(悬点和小钉未摄入),P为摆动中的最低点,每相邻两次闪光的时间间隔相等。则小钉距悬点的距离为( )

A.L/4 B.L/2 C.3L/4 D.条件不足,无法判断
18.如图所示,L为一透镜,在透镜左侧某处放有一点光源,ab和oc为点光源射向透镜的光线中经透镜射出的两条光线,其中ab平行主轴,oc与主轴成θ角,由此判断透镜L不可能是(设o、a两点的距离为r)
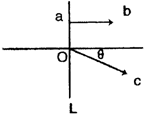
A.焦距大于r·ctgθ的凸透镜
B.焦距小于r·ctgθ的凸透镜
C.焦距大于r·ctgθ的凹透镜
D.焦距小于r·ctgθ的凹透镜
19.如图所示,用铝板制成U形框,将一质量为m的带电小球用绝缘细线悬挂在框的上方,使整体在匀强磁场中沿垂直于磁场方向向左以速度v匀速运动,悬线拉力为T,则( )

A.悬线竖直,T=mg
B.悬线竖直,T>mg
C.悬线竖直,T<mg
D.无法确定T的大小和方向
20.据报道,美国航天局已计划建造一座通向太空的升降机,传说中的通天塔即将成为现实。据航天局专家称:这座升降机的主体是一根长长的管道,一端系在位于太空的一个巨大的人造卫星上,另一端一直垂到地面并固定在地面上。已知地球到月球的距离约为地球半径的60倍,由此可以估算,该管道的长度至少为(已知地球半径为6400km)
A.360km B.3600km C.36000km D.360000km
第Ⅱ卷(非选择题,共180分)
21.(18分)材料一:美国“9·11”事件使四千多人遇难,事后的尸体辨认只能借助于DNA杂交技术。该方法是从尸体和死者家属提供的死者生前的生活用品中分别提出DNA,在一定温度下水浴共热,使DNA氢键断裂,双链打开。若两份DNA样本来自同一个体,在温度降低时,两份样本中的DNA单链会通过氢键连接在一起;若不是来自同一个体,则两份样本中的DNA单链一定程度上不能互补。DNA杂交技术就是通过这一过程对面目全非的尸体进行辨认。
请根据上述材料回答下列问题:
(1)人体内的DNA主要存在于细胞核中的染色体上,人的几乎所有体细胞具有相同的染色体组成,原因是__________________________。
(2)为保证实验的准确性,需要较多的DNA样品,这可通过PCR技术使DNA分子大量复制。若一个DNA分子中,腺嘌呤含量为15%,复制所用的原料为3H标记的脱氧核苷酸,经四次复制后,不含3H的单链占全部单链的________,子代DNA分子中胞嘧啶的比例为________。
材料二:2000年诺贝尔医学奖被授予了对神经系统信号传导的研究有突出贡献的三位科学家。他们发现两个神经细胞之间通过“突触”连结,下图表示一种脊椎动物普遍具有的化学突触及信号传导过程,请回答:
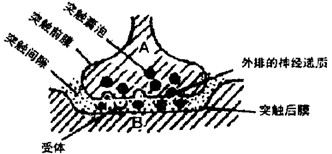
(1)突触间隙的存在,使神经信号的传导只有在神经递质(如乙酰胆碱)参与下才能完成。神经递质由A细胞合成经过_________(细胞器)包装加工,形成突触囊泡,后者再与___________融合,而将神经递质分泌进入突触间隙。
(2)突触后膜上“受体”与相应神经递质结合,引起B细胞的反应。膜上“受体”的化学本质最可能是_______。
22.(15分)使用含磷洗衣粉可使水体富营养化,造成环境污染。例如我国的太湖、滇池等水域均因含有含磷洗衣粉的生活废水污染而使水质变差。为了防止水体富营养化,我国很多城市推广使用无磷洗衣粉。现假设某天工商管理人员突击检查某超市出售的无磷洗衣粉。请你用生物学方法设计一个实验来检测该超市出售的是否真是无磷洗衣粉?
提供的用具:布网、水桶、药勺、玻璃棒、三个水糟、PH试纸、显微镜、玻片。
提供的药品:NH4NO3、Na2CO3、含磷洗衣粉、超市出售的无磷洗衣粉、清水。(注:洗衣粉溶液呈弱酸性)
实验过程:1.用布网在郊外的无污染池塘中拖动,以获得单细胞藻类。
2.装1桶水,将布网中的藻类冲到桶中的水里,并向水中加少量NH4NO3。
3.
结果预测:
23.(15分)某人早晨吃了一个馒头,一段时间后从此人的消化道中取出一些液体。
(1)对液体进行了一些处理之后,加入银氨溶液,产生了银镜现象,能否说淀粉已完全水解,为什么?
(2)如果反应需1mol银氨铬离子,则反应消耗了______mol葡萄糖,反应后葡萄糖所变的物质的结构简式为____________。
(3)此人吃完早餐后立即到操场上跑了几圈,感到浑身有些乏力(血糖低的原因),则血液中的糖靠_________分解补充,肌肉活动所需的能量由_________直接提供。
(4)此人一次性大量吃糖后,血液中的葡萄糖可能会随________排出体外。
24.(12分)X、Y、Z是主族元素的单质,K、H是化合物,它们有如下反应(式中各物质的系数和反应条件均已略去):
(1)①X+K→H+Y;②X+Z→H;③Y+Z→K。
若x和Y的组成不是同一族,请写出符合①式的2个不同的化学方程式,并配平,2个式子中的2种X和2种Y分别由不同族的元素组成:
(2)今有某化合物W,它跟化合物K或CO2反应,都能生成单质Y。符合该条件(题设的3个“通式”)的单质X是_______,单质Y是_______,单质Z是_______,化合物W是_______(均写化学式)。
25.(20分)某一种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1mol·L-1的HCl溶液和0.lmol·L-1的NaOH溶液
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20mL蒸馏水
③以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,需用去VxmL达滴定终点
④加入25mL0.1mol·L-1的HCl溶液
(1)写出实验过程的步骤________(写编号顺序)
(2)下图所示的仪器中配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液肯定不需要的仪器是________(填字母代号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)

(3)配制上述两种溶液应选用的容量瓶规格分别为________(填字母)
A.50mL,50mL B.100mL,100mL
C.100mL,150mL D.250mL, 250mL
(4)写出相关的化学反应方程式:________________
(5)胃药中含碳酸钙的质量为:_____________(写出计算式)
26.(21分)工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一、原料、反应条件、平衡转化率、日产量
| 物质 物质 | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2、CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二、原料来源生产工艺
| 反应过程 原料 | 原料生产工艺过程 |
| 乙炔 | CaCO3 |
| 乙烯 | 来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛:________________________________
b.乙烯氧化法制乙醛:________________________________
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因:
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?________________
(4)若将上述两种方法的反应条件,均增加“100atm”,原料平衡转化率(填增大、减小、不变);而实际生产中不采用的理由是__________________________________________
____________________
(5)若乙烯由石油裂化气(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气各多少mol?(用m、n代数式表示)
27.(20分)将甲、乙两铂片插入200g10%的CuSO4溶液中进行电解,当阳极析出0.16g气体时,求:
(1)阴极析出多少克铜?CuSO4溶液的质量分数是多少?
(2)需要多少电量?
(3)若在12V的电压下需要多少电能?
(4)在压强为latm,温度为27℃时,氧气的体积为多少?(标准状态为PO=latm,T=273K)
28.(20分)为了测定和描绘“220V40W”白炽电灯灯丝的电流与电压的关系曲线(伏安特性曲线),可以利用调压变压器供电。调压变压器是一种自耦变压器,它只有一组线圈L,绕在闭合的环形铁心上,输入端接在220V交流电源的火线与零线间,输出端有一个滑动触头P,移动它的位置,就可以使输出电压在0~250V之间连续变化,图1中画出的是调压变压器的电路图符号。实验室备有交流电压表,交流电流表,开关,导线等实验器材。
1.在图1中完成实验电路图,要求电流表采用外接法。

2.如果电表的内阻的影响不能忽略,根据实验电路图测量时,在电压较高段与电压较低段相比较,哪段的误差更大?为什么?
答:________________________________________________________________________
__________________________________________。
3.如果根据测量结果作出的伏安特性曲线如图2所示,试根据图线确定,把两个完全相同的“220V40W”白炽电灯串联在220V交流电源的火线与零线间,这两只电灯消耗的总功率是_________。

4.若将滑动变阻器作分压式电路连接,也可以完成上述实验,本实验采用调节变压器供电,而不采用滑动变阻器,最主要的原因是前者有明显的_________的作用。
29.(20分)如图,一劲度系数K=800N/m的轻弹簧两端各焊接着两个质量均为M=12kg的物体A、B,直立于水平地面而静止。现在加一个竖直向上的力F在物体A上,使A由静止开始向上做匀加速运动、经0.4s,B刚要离开地面,设整个过程弹簧都处于弹性限度内(g取l0m/s2),求:

(1)B刚要离开地面时,弹簧的形变量;
(2)在此过程中所加外力F的最大值和最小值;
(3)在此过程中力F所做的功。
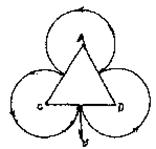
30.(19分)如图所示,正三角形ACD是一用绝缘材料制成的固定柜架,边长为L,在框架外是范围足够宽的匀强磁场,磁感应强度为B,方向垂直于纸面向里,ACD可视为磁场的理想内边界。在框架内有一对带电平行极板M、N,M板的中点K处有一粒子源,能够产生速度为零、质量为m、电量为q的带正电的粒子,粒子重力不计。带电粒子经两极板间的电场加速后从CD边中心的小孔S垂直于CD边射入磁场。若这些粒子与框架的碰撞为弹性碰撞,且每一次碰撞时速度方向均垂直于被碰的边框。要使粒子在最短的时间内回到小孔S,求:

(1)粒子做圆周运动的轨道半径,并画出粒子在磁场中的运动轨迹和绕行方向;
(2)两极板M、N间的电压;
(3)粒子回到小孔S的最短时间。
株洲市第二次高考模拟考试
参考答案
1.C 2.C 3.A 4.C 5.D 6.B 7.D 8.B 9.B 10.A 11.A 12.D 13.B 14.B 15.D 16.B 17.C 18.D 19.A 20.C
21.(18分)材料一:(1)一个人的所有体细胞均来自一个受精卵细胞的有丝分裂(3分)
(2)1/16(3分) 35%(3分)
材料二:(1)高尔基体(3分) 细胞膜或突触前膜(3分)
(2)蛋白质(或糖蛋白)(3分)
22.(15分)实验过程:3.搅拌均匀,倒入三个标记有甲、乙、丙的水槽中。(3分)
4.向乙水槽中加入少量超市出售的无磷洗衣粉,向丙水槽中加等量含磷洗衣粉(3分)
5.分别用Na2CO3调节乙、丙水槽中的pH值,使其与甲相同。(3分)
6.一段时间后,分别从三个水槽中取水样,镜检其中藻类数量。(3分)
结果预测:如果该无磷洗衣粉不含磷,则甲、乙水槽中藻类数量差别不大,且明显少于丙;如果该无磷洗衣粉只是换一下包装,还是含磷洗衣粉,则乙、丙水槽中藻类数量差别不大,且明显多于甲;如果该无磷洗衣粉是无磷和有磷洗衣粉的混合物,则丙中藻类最多,甲中最少,乙中介于甲、丙之间。(3分)
23.(15分)(1)不能。产生银镜现象只能说明淀粉进行了分解,如果加碘水溶液不变蓝,则表明淀粉已完全分解。(5分)
(2)0.5;CH2OH(CHOH)4COOH(4分)
(3)肝糖元;ATP(4分)
(4)尿液(2分)
![]() ③H2S+Cl2
③H2S+Cl2![]() 2HCl+S(任写两个计4分,每一个2分)
2HCl+S(任写两个计4分,每一个2分)
(2)X:F2 Y:O2 Z:H2 W:Na2O2(每空2分,共8分)
25.(20分)(1)①②④③或②①④③(4分)
(2)A、C; 烧杯、玻璃棒(每空2分,共6分)
(3)B(2分)
(4)CaCO3+2HCl![]() CaCl2+H2O+CO2↑
CaCl2+H2O+CO2↑
NaOH+HCI![]() NaCl+H2O(4分)
NaCl+H2O(4分)
(5)0.125-0.005Vx(4分)

(2)答:①从表一来看:两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多。②从表二来看:乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,较难获得;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得。(6分)
(3)乙烯氧化法快;(2分)
(4)增大;(1分)因为两种方法在相应反应条件下,转化率都已经很高、增大压强将消耗能量和增加设备,不经济。(2分)
(5)解:要得到40mol的乙稀,则会生成5molCH4,10molC3H6。若设生成xmol丁二烯(C4H6)和ymolH2,a需要催化裂解amol的CnHm。
则:根据C守恒:an=5+30+80+4x=115+4x (2分) ①
根据H守恒:am=20+60+160+6x+2y=240+6x+2y (2分) ②
根据题意:x+y=100—55=45 ③
联立①②③求得:![]() (1分)
(1分)
![]() (1分)
(1分)
27.(20)分)解:(1)设阴极析出Cu为x,消耗CuSO4为y,由电解CuSO4溶液的电极反应:
阴极:2Cu2++4e=2Cu(1分)
阳极:4OH--4e=2H2O+O2↑(1分)
得生成物Cu和O2的关系为:

x=0.64g(2分) y=1.6g
所以CuSO4溶液的质量分数为:
![]() (3分)
(3分)
(2)由(1)知阴极析出0.01molCu所需的电量为
q=0.02×1.6×10-19×6.02×1023 C=1.93×103C (3分)
(3)需要的电能为E=qU
E=1.93×103×12J=2.32×104J (4分)
(4)0.16g氧化为0.05mol,在标准状态下的体积为0.112L,由理想气体状态方程得:
![]() 即
即![]()
解得:氧气的体积V1=0.123L (4分)
28.(1)如图。变压器输入端电路和输出电路各4分。开关应连在火线一边,否则应适当扣分。火线与公共端相连的可不扣分
(2)电压较高段误差更大(2分)。因为电压越高,灯丝电阻越大,由于电压表分流而产生的误差就越大(3分)
(3)48W±2W(4分) (4)节能 (3分)
(2)电压较高段误差更大(2分)。因为电压越高,灯丝电阻越大,由于电压表分流而产生的误差就越大(3分) (3)48W±2W(4分) (4)节能 (3分)
29.(20分)解:(1)设B刚要离开地面时,弹簧的形变量为xl
则![]()
![]() ①
①
(2)A静止时,设弹簧压缩了x2,因受力平衡,有:kx2=Mg ②
施加向上力使A刚做匀加速运动时的最小力设为Fl有:F1+kx2—Mg=Ma ③
当B刚要离开地面时,对系统施加的最大力为F2对系统有:F2—2Mg=Ma ④
由位移公式对A有:![]() ⑤
⑤
则①、②式,得:xl=x2=0.15m ⑥
由⑤、⑥解得:a=3.75m/s2 ⑦
由②④⑦得力的最小值为:F1=45N ⑧
力的最大值为:F2=285N ⑨
(3)在力作用的 0.4s内,在初末状态有x1=x2,弹性势能相等,由能量守恒知。
WF=Mg(xl+x2)+![]() M(at)2=49.5J
M(at)2=49.5J
说明:①、②、③、④、⑤、⑧、⑨各2分,得出弹性势能不变2分,⑩4分。
30.(19分)(1)粒子在磁场中做匀速圆周运动,与边框垂直碰撞后要重新回到S,由几何关系可知,A、C、D三点必为圆轨道的圆心,要使粒子回到S的时间最短,圆轨道半径为R=![]() ①
①
轨迹如图所示
(2)粒子经电场加速,有qU=![]() mv2 ②
mv2 ②
粒子在磁场中运动,有qvB=mv2/R ③
由①、②、③三式解得:U=![]() ④
④
(3)粒子在磁场中做匀速圆周运动的周期为
T=![]() ⑤
⑤
粒子回到S的最短时间为t=3×![]() ⑥
⑥
说明:①式5分,②、③、④、⑤、⑥各2分,粒子径迹正确3分,方向正确1分。