高考等值诊断试卷理科综合三
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至20题,第Ⅱ卷21至25题。全卷共300分。考试用时150分钟。
注意事项:
1.答题前,考生务必将自己的姓名、准考证号填写在试卷和答题卡上。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用
橡皮擦干净后,再选涂其它答案标号。答在试题卷上无效。
3.考试结束,监考人员将本试题卷和答题卡一并收回。
以下数据可供解题时参考:
相对原子质量(原子量):H 1 C 12 N 14 O 16 Na 23 Cl 35.5 S 32 Fe 56
第Ⅰ卷(共21小题,每小题6分,共126分)
一、选择题(本题包括13小题。每小题只有一个选项符合题意)
 1.右图表示神经元联系的一种形式。适宜刺激的结果是
1.右图表示神经元联系的一种形式。适宜刺激的结果是
A.刺激a处,b处将连续兴奋或抑制,c处也发生电位变化
B.刺激b处,不会引起a和c处发生电位变化
C.刺激c处,a和b处都会发生兴奋或抑制
D.刺激a处,b、c同时产生兴奋或抑制
2.右图为某植物在夏季晴天一昼夜内CO2吸收量的变化情况,以下判断正确的是( )
|
②植物在a和h时刻只进行呼吸作用,
不进行光合作用
③影响bc段光合速率的外界因素只有
光照强度
④ce段与fg段光合速率下降的原因相同
⑤若c、f时刻的光合速率相等,则植物呼
吸速率为c时刻大于f时刻
⑥该植物处于生长时期
A.①③ B.②④ C.①⑤ D.②⑥
3.下列有关微生物的叙述中正确的是( )
A.人工诱变、细胞工程、基因工程等都能对微生物进行定向改造
B.环境条件的变化对微生物的代谢途径会产生影响
C.单细胞蛋白是从单个微生物中提取出来的蛋白质
D.微生物总是先合成初级代谢产物后合成次级代谢产物,不可能同时合成这两类产物
4.美国科学家安德鲁·法尔和克雷格·梅洛发现了RNA干扰机制而荣获2006年度生理学或医学奖。正常的mRNA称为正义RNA,而与正义RNA互补配对的RNA称为反义RNA,正义RNA与反义RNA混合后生成双链RNA(dsRNA),正是dsRNA导致产生了RNA干扰现象(RNAi现象)。dsRNA在生物体内是存在的,是一种自然现象,经酶切后会形成很多小片段称为siRNA,这些小片段一旦与mRNA中的同源序列互补结合,会导致该mRNA失去功能,不能翻译产生蛋白质,也就是使基因“沉默”了。请根据上述材料判断下列哪项是错误的? ( )
A.形成dsRNA的过程中会发生碱基互补配对
B.siRNA形成是因为酶切开了氢键
C.若某DNA片段的非模板链为ATTGAC,则dsRNA为![]()
D.RNAi作用的最终结果是使遗传信息不能以蛋白质形式表达出来
5.下图表示某处于平衡状态的生物种群因某些外界环境变化导致种群中生物个体数量改变时的四种情形,下列有关产生这些变化的原因的分析中,正确的是( )
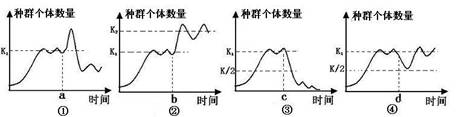
(1)若图①示草原生态系统中某种群,则a点后的变化原因可能是过度放牧
(2)若图②示某发酵罐中菌种数量,则b点后的变化原因可能是增加营养供应
(3)图③中c点后发生的变化表明生态系统的抵抗力稳定性有一定限度
(4)图④曲线可用于指导海洋捕捞
A.只有一种说法正确 B.只有两种说法正确
C.只有三种说法正确 D.四种说法都正确
6.![]() 为阿伏加德罗常数,下列说法正确的是(
)
为阿伏加德罗常数,下列说法正确的是(
)
A、10g甲烷所含有的电子数目为10NA
B、常温常压下,4g氦气所含有的中子数目为4NA
C、标准状况下,22.4L单质溴所含有的原子数目为2NA
D、电解食盐水若产生2g氢气,则转移的电子数目为2NA
7.下列各组离子因发生氧化还原反应而不能大量共存的是( )
A、OH-、Na+、SO32-、S2- B、Fe3+、H+、NO3-、Cl-
C、H+、K+、SO32-、S2- D、Cu2+、Na+、S2-、SO42-
8.下列叙述正确的是( )
A、极性分子中不可能含有非极性键 B、离子化合物中不可能含有非极性键
C、非极性分子中不可能含有极性键 D、共价化合物中不可能含有离子键
9.关于工业生产的下列叙述,不正确的是( )
A.将氢气和氯气混合后光照,使其反应生成氯化氢,再用水吸收得盐酸
B.用硝酸镁作吸水剂,将稀硝酸蒸馏,浓缩制得95%以上的浓硝酸
C.以石灰石、纯碱、石英为原料,在玻璃窑中加强热制取普通玻璃
D.工业上采用电解熔融氯化镁的方法制取金属镁
10.下列各组物质,可用一种试剂加以区别的是( )
①四种黑色固体FeO、FeS、Fe、CuO
②四种白色粉末(NH4)2SO4、NH4Cl、Na2SO4、NaCl
③四种无色溶液:乙醇、乙醛、乙酸、甲酸
④四种有机溶剂:苯、四氯化碳、乙烯、无水乙醇
A.①② B.③④ C.①②④ D.全部
11.下列叙述中不正确的是( )
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池跟电解池连接后,电子从电池负极流向电解池阳极
C.电镀时,电镀池里的阳极材料发生氧化作用
D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
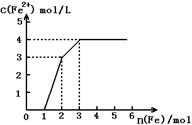 12.已知:2Fe3+
+ Cu =Cu2+ +2Fe2+ 。现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,若向其中逐渐加入铁粉,且Fe与稀硝酸反应的还原产物仅为NO。,溶液中Fe2+ 浓度和加入铁粉的物质的量之间关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
12.已知:2Fe3+
+ Cu =Cu2+ +2Fe2+ 。现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,若向其中逐渐加入铁粉,且Fe与稀硝酸反应的还原产物仅为NO。,溶液中Fe2+ 浓度和加入铁粉的物质的量之间关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
A.1︰1︰1
B.1︰3︰1
C.3︰3︰8
D.1︰1︰4
13.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是( )
A.pH > 7,且c(Na+) >c(OH—) > c(CH3COO—) > c(H+)
B.pH > 7,且c(Na+) + c(H+) = c(OH—) + c(CH3COO—)
C.pH < 7,且c(CH3COO—) > c(H+)> c(Na+) > c(OH—)
D.pH = 7,且c(CH3COO—) > c(Na+)> c(H+) = c(OH—)
二.选择题(本题包括8小题。共48分。每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分)
14. 在完全透明的水面下放一点光源,在水面上能看到一个圆形的透光面,若看到透光面圆心的位置不变而半径不断增大,则光源正在( )
A. 上浮 B. 下沉
C. 同一深度水平方向作圆周运动 D. 不动
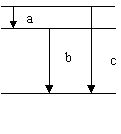 15. 一群处于基态的氢原子吸收了某种频率的光子后,向外辐射出了3种频率的光子a、b、c,如图所示,则( )
15. 一群处于基态的氢原子吸收了某种频率的光子后,向外辐射出了3种频率的光子a、b、c,如图所示,则( )
A. a的波长最短
B. c 的频率最大
C. b 的光子的能量比c的大
D. 被氢原子吸收的的光子的能量与c光子的能量一样大
16.下列叙述中,正确的是( )
A.当分子间距离等于r0 时,分子势能为负且最小
B.物体内所有分子动能的总和叫做物体的内能
C.布朗运动就是分子所做的无规则运动
D.一定质量的气体,温度升高时,分子间的平均距离一定增大
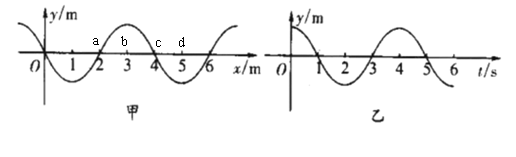
17.如图,甲是一列简谐波沿x轴正方向传播时t=0时刻的波形图,乙是这列波中某一质点在该时刻9秒后开始计时的位移-时间图像,图乙描述的是甲图中a、b、c、d 哪一质点的振动情况
A.a B.b C.c D.d
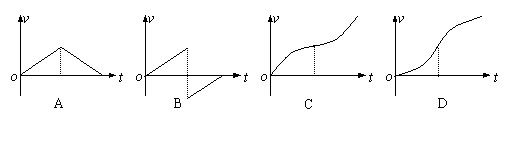
 18.一个物体在多个力的作用下处于静止状态。如果仅使其中的一个力大小逐渐减小到零,然后又从零逐渐恢复到原来的大小(此力的方向始终未变),在这过程中其余各力均不变.那么,下列各图中能正确描述该过程中物体速度变化情况的是( )
18.一个物体在多个力的作用下处于静止状态。如果仅使其中的一个力大小逐渐减小到零,然后又从零逐渐恢复到原来的大小(此力的方向始终未变),在这过程中其余各力均不变.那么,下列各图中能正确描述该过程中物体速度变化情况的是( )

19.最近,科学家在望远镜中看到太阳系外某一恒星有一行星,并测得它围绕该恒星运行一周所用时间为1200年,它与该恒星的距离为地球到太阳距离的100倍,假设该行星绕恒星运行的轨道和地球绕太阳运行的轨道都是圆周,仅利用以上两个数据可以求出的量有( )
A.恒星质量和太阳质量之比
B.恒星密度和太阳密度之比
C.行星质量与地球质量之比
D.行星运行速度与地球公转速度之比
20.来自宇宙的质子流,以与地球表面垂直的方向射向赤道上空的某一点,则这些质子在进入地球周围的空间时将( )
A. 竖直向下沿直线射向地面
B. 相对于预定地点向东偏转
C. 相对于预定地点,稍向西偏转
D. 相对预定地点,稍向北偏转
 21. 如图所示,在光滑的水平面上放有两个质量分别为M=3kg的薄板和m=1kg的物体,各以4m/s的初速度朝相反方向运动,它们之间有摩擦,薄板足够长,当薄板的速度为2.4m/s时,物块的运动情况是( )
21. 如图所示,在光滑的水平面上放有两个质量分别为M=3kg的薄板和m=1kg的物体,各以4m/s的初速度朝相反方向运动,它们之间有摩擦,薄板足够长,当薄板的速度为2.4m/s时,物块的运动情况是( )
A. 做加速运动 B. 做减速运动
C. 做匀速运动 D. 以上情况都可能
第Ⅱ卷(共10题,共174分)
22.(17分)
(1)(4分)如图所示,A、B是多用表在进行不同测量时转换开关分别指示的位置,C是多用表指针在测量时的偏转位置,由此可知
A图是__________挡,若用此挡测量,指针位置如C,则读数是_____________;
B图是__________挡,若用此挡测量,指针位置如C,则读数是_____________。
 |
(2)(13分)测量两只内阻未知的电流表的内阻,给出下列器材:
A. 电流表G1 (10mA, 内阻100Ω左右)
B. 电流表G2 (5mA, 内阻150Ω左右)
C. 定值电阻R1 =100 Ω
D.定值电阻R2 =10 Ω
E.滑动变阻器R3 (0~200Ω)
F. 滑动变阻器R4 (0~10Ω)
G. 干电池1.5 V, 内阻未知
H.单刀单掷开关
I.单刀双掷开关
J. 导线若干
I.在实线框中划出实验电路设计图
II.你要选择的器材是 。(写出字母代号)
III.将实物仪器用笔画线代替导线按要求连接起来。

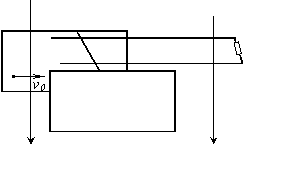
23.(16分)如图所示,M、N为竖直放置的两平行金属板,两板相距d=0.4m.EF、GH为水平放置的且与M、N平行的金属导轨,其右端(即F、H处)接有一R=0.3Ω的电阻,导轨与M、N的上边缘处在同一水平面上,两导轨相距L=0.2m.现有一长为0.4m的金属棒ab与导轨垂直放置,并与导轨及金属板接触良好,金属棒ab的总电阻为r=0.2Ω,整个装置处于竖直向下的匀强磁场中,磁场的磁感应强度B=1T.现有一个重力不计的正电荷,以v0=7m/s的速度从金属板的左端水平向右射入板间,为了使电荷能做匀速直线运动,试求:
(1)ab棒应向哪个方向匀速运动?ab运动的速度为多大?
(2)如果金属棒的质量m=0.4kg(取g=10m/s2),金属棒与导轨和金属板间的动摩擦因数都为![]() ,则拉动金属棒向前运动的水平拉力多大?
,则拉动金属棒向前运动的水平拉力多大?
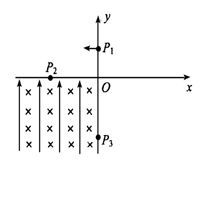 24.(19分)如图所示的坐标系,x轴沿水平方向,y轴沿竖直方向。第一、第二和第四象限内,既无电场也无磁场。在第三象限,存在沿y轴正方向的匀强电场和垂直坐标平面向里的匀强磁场一质量为m、电荷量为q的带电质点,从y轴上y=h处的P1点,以一定的水平初速度沿x轴负方向进入第二象限;然后经过x轴上x=-2h处的P2点进入第三象限,带电质点恰好能做匀速圆周运动,经y轴y=-2h的P3点离开电磁场求:
24.(19分)如图所示的坐标系,x轴沿水平方向,y轴沿竖直方向。第一、第二和第四象限内,既无电场也无磁场。在第三象限,存在沿y轴正方向的匀强电场和垂直坐标平面向里的匀强磁场一质量为m、电荷量为q的带电质点,从y轴上y=h处的P1点,以一定的水平初速度沿x轴负方向进入第二象限;然后经过x轴上x=-2h处的P2点进入第三象限,带电质点恰好能做匀速圆周运动,经y轴y=-2h的P3点离开电磁场求:
(1)粒子到达P2点时速度的大小和方向;
(2)第三象限内电场强度和磁感应强度的大小。
25.(20分)如图所示,挡板P固定在足够高的水平桌面上,小物块A和B大小可忽略,它们分别带有+qA和+qB的电荷量,质量分别为mA和mB.两物块由绝缘的轻弹簧相连,一不可伸长的轻绳跨过轻滑轮,一端与B连接(绳与桌面平行),另一端连接一轻质小钩.整个装置处于场强为E、方向水平向左的匀强电场中.A、B开始时静止,已知弹簧的劲度系数为k,不计一切摩擦及A、B之间的库仑力,A、B所带电荷量保持不变,B不会碰到滑轮.
(1) 若在小钩上挂一质量为M的物块C并由静止释放,当C下落到最低点时,可使物块A对挡板P的压力恰为零,但不会离开P,求物块C下降的最大距离;
 (2) 若C的质量改为2M,则当A刚离开挡板P时,B的速度多大?
(2) 若C的质量改为2M,则当A刚离开挡板P时,B的速度多大?
26.(16分)下图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2 mol X、2 mol Y,起始时,VA = a L,VB = 0.8 a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g) + 3Y(g) ![]() 2Z(g) + 2W(g),达到平衡时,VB = 0.6 a
L。
2Z(g) + 2W(g),达到平衡时,VB = 0.6 a
L。

试回答下列问题:
(1)B中X的转化率为_____________。
(2)A、B中X的转化率的关系是A_______B(填“>”“=”“<”),其理由是___________________。
(3)平衡时A、B中混合气体的平均相对分子质量的关系是:MA______MB(填“>”“=”“<”)。
(4)如果要计算出平衡时B中混合气体的密度,则至少还需要知道的数据是_____________(MX、MY、MZ、MW分别表示X、Y、Z、W的摩尔质量)。
①MX ②MY ③MZ ④MW
A.③和④ B.①和② C.①和③ D.②③④
(5)打开K,一段时间后反应再次达到平衡,则B的体积为________L。
27(14分).A~J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂。
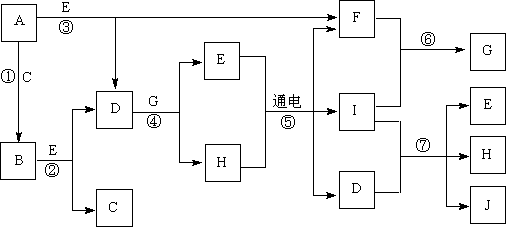
(1)写出反应⑤的化学方程式:_________________________________。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:____________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:__________________。________极(填“阴”或“阳”)附近溶液由无色变为红色。
28.(16分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
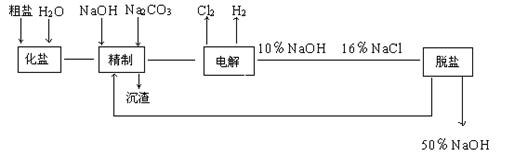
依照图示,完成下列填空:
⑴ 在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为___________与电源负极相连的电极附近,溶液PH值__________(选填:不变,升高或下降)。
⑵ 工业食盐含Ca2+ 、Mg2+等杂质,精制过程发生反应的离子方程式为________________ 。
⑶如果粗盐中SO42- 含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是__________。
A.Ba (OH)2 B.Ba (NO3 )2 C.BaCl2
⑷ 为有效除去Ca2+ 、Mg2+ 、 SO42-,加入试剂的合理顺序为_______(选填A、B、C,多填扣分)。
A.先加NaOH,后加 Na2CO3,再加钡试剂。
B.先加NaOH,后加钡试剂,再加Na2CO3。
C.先加钡试剂,后加NaOH,再加Na2CO3。
⑸ 脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______冷却、_______(填写操作名称)除去NaCl。
 29.(14分)有机物M(分子式为C8H13O2Br)在不同条件下,能发生如下转化关系,其中只有A物质既能使溴水褪色,又能和Na2CO3溶液反应放出CO2气体,D是终可被氧化成
29.(14分)有机物M(分子式为C8H13O2Br)在不同条件下,能发生如下转化关系,其中只有A物质既能使溴水褪色,又能和Na2CO3溶液反应放出CO2气体,D是终可被氧化成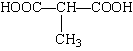 。
。
请回答下列问题:
(1)B经过催化氧化再与NaOH的醇溶液作用、酸化过程可转化为A,推断A物质中含有的官能团为__________________。
(2)A转化为C和B转化为D都在碱性条件下进行,则它们的反应类型为__________。
(3)写出有机物M的结构简式_______________________。
(4)往溴水中加入C溶液,可使溴水褪色,其主要反应的离子方程式为____________。
(5)与A具有相同官能团的A的同分异构体的结构简式为__________。
30.(22分)某生物兴趣小组同学发现在校园向阳处的蒲公英的叶片较大,叶缘缺刻小,大多数近于全缘,而生长在校园荫蔽处的蒲公英的叶片较小,叶缘缺刻大,大多数呈锯齿状。为了探究环境和遗传因素对蒲公英的叶形的影响,请你完成以下实验设计。
提示:切取蒲公英的直根,埋入潮湿的沙土中催芽,可进行无性繁殖。
(1)做出的假设: 。
(2)实验步骤:
①在校园的向阳处选取生长良好的蒲公英,将其连根刨出。
② ,埋入装有潮湿沙土的花盆中催芽。
③待蒲公英发芽后,分别移载到装有相同沃土的花盆A和花盆B中,将A花盆放在 ,B花盆放在 。
④ 。
⑤经过一段时间后,观察生长情况。
(3)实验结果与结论
①如果A、B两盆蒲公英叶片较大,叶缘缺刻小,大多数近于全缘。说明
。
②如果A盆蒲公英叶片较大,叶缘缺刻小,大多数近于全缘,而B盆蒲公英的叶片较小,叶缘缺刻大,大多数呈锯齿状。说明 。
(4)讨论:
①本实验中第②步让蒲公英进行无性繁殖,其目的是 。
②做完实验后,有同学提出本实验还不能完整地解决他们观察到的现象,还有待于进一步探究。请你在上述实验的基础上,简要叙述相关步骤。
31.(20分)为了探究同一植物不同器官对生长素的反应,某生物学研究小组利用以下材料用具进行了实验探究,得到下表的数据。
材料用具:
培养皿、量筒、直尺、培养液(可用于植物组织培养)、不同浓度的生长素溶液、已切去尖端的某种植物的胚根和胚芽各50条(初始长度均为10mm)。
实验数据:
| 生长素溶液浓度(mol/L) | 10-13 | 10-12 | 10-11 | 10-10 | 10-9 | 10-8 | 10-7 | 10-6 | 10-5 | 10-4 | |
| 3天后的平均长度 (mm) | 胚芽 | 12.3 | 12.3 | 12.7 | 13.5 | 14.7 | 16.0 | 15.1 | 12.2 | 10.8 | 10.0 |
| 胚根 | 11.3 | 12.1 | 12.7 | 13.6 | 12.6 | 12.0 | 10.9 | 10.0 | 10.0 | 10.0 | |
⑴写出实验步骤的第二步和第四步。
第一步,取20套洁净的培养皿。分别编号为A1、A2、A3….A10和a1、a2、a3……a10。在 上述培养皿中均加入适量且等量的培养液,然后再在上述培养皿中分别加入适量且等量的浓度为10—13moI/L、10—12mol/L、……10—4mol/L的生长素溶液。
第二步:
第三步:将上述培养皿放在相同的适宜条件下培养。
第四步:
⑵将本研究小组获得的实验数据绘制成坐标图。

⑶ 根据本研究小组的实验数据,可以得出的实验结论是:
① 。
② 。
③ 。
⑷ 在本实验中,为什么要切去胚根和胚芽的尖端?
(2分)

