高三下学期理综第七次月考
理综试题
命题:杨金伟、鲁氢、刘成军 审核:黄文、付晓健、荣海
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Al 27 Si 28 Br 80
第I卷(非选择题,共126分)
1、细胞质基质、线粒体基质和叶绿体基质的
A.功能及所含有机化合物都相同 B.功能及所含有机化合物都不同
C.功能相同,所含有机化台物不同 D.功能不同,所含有机化合物相同
2、一条食物链中,若生产者固定太阳光能时产生6a mol氧气,则三级消费者贮存在ATP中的能量最多是
A.9.288a kJ B.46.44a kJ C.1.16a kJ D.13.67a kJ
3、对某植物测得如下数据,若该植物处于白天均温30°,晚上均温15°C,有效日照15h环境下,请预测该植物1天中积累的葡萄糖为:
| 30℃ | 15° | |
| 一定光照10h | 黑暗下5h | |
| O2净释放量640mg | CO2净释放220mg | 5h释放110mg CO2 |
A.765mg B.1485mg C.315mg D.540mg
4、把左右手分别插入60℃和10℃水中一段时间后,然后同时把两手再插入40℃的水中。这时左右手皮肤温度感受器兴奋的分别是
①温觉感受器 ②冷觉感受器
A.①① B.②② C.①② D.②①
5、质粒是基因工程常用的运载体,它的主要特点是
①能自主复制 ②不能自主复制 ③结构很小 ④蛋白质 ⑤环状RNA ⑥环状DNA⑦能“友好”的“借居”
A.①③⑤⑦ B.②④⑥ C.①③⑥⑦ D.②③⑥⑦
6.13C—NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wuthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
7.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
8.下列各组数据中,前者比后者大的是
A.相同温度下,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-离子浓度
B.100mL 0.1 mol/L的CH3COOH溶液与10 mL 0.1mol/L的CH3COOH溶液中的H+离子的数目
C.Na2CO3溶液中HCO3-和OH-数目
D.纯水在100℃和20℃时的pH
9.下列关于元素周期表和元素周期律的叙述中,正确的是
A.元素的性质随着相对原子质量的递增,呈周期性的变化
B.周期表中,原子序数都等于该族元素原子的最外层电子数
C.第三周期中,随着核电荷数的递增,元素的离子半径依次减小
D.随核电荷数的递增,ⅦA族元素的单质熔、沸点升高,碱金属单质熔、沸点降低
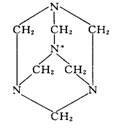 10.环六次甲基四胺是一种重要的化工原料,其结构式如下图所示:环六次甲基四胺的分子具有高度的对称性,分子中同种元素
10.环六次甲基四胺是一种重要的化工原料,其结构式如下图所示:环六次甲基四胺的分子具有高度的对称性,分子中同种元素
原子的成键情况都完全相同。下列关于环六次甲
基四胺分子结构的叙述中正确的是
A.分子中所有N原子和C原子都处于同一平面上
B.结构中带*号的N原子处于分子的中心
C.分子中含有3个相同的C、N交替排列的六元环
D.连接分子中的4个N原子可构成一个正四面体
11.某溶液中含有HCO3-、SO32-、SiO32-、Cl-等四种离子,若向其中加入某种试剂后,发现溶液中仅有HCO3-、SO32-两种离子数量大量减少。则加入的试剂可能是
A.盐酸 B.过氧化钠 C.双氧水 D.氯化钡溶液
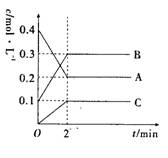 12.如下图所示,800℃时,A、B、C三种气体在密闭容器中,反应时浓度的变化,只从图上分析不能得出的结论是
12.如下图所示,800℃时,A、B、C三种气体在密闭容器中,反应时浓度的变化,只从图上分析不能得出的结论是
A.A是反应物
B.前2 minA的分解速率是0.1 mol·(L·min)-1
C.若升高温度,A的转化率增大
D.增大压强,A的转化率减小
13.一种新型燃料电池,以镍板为电极插入KOH溶液中分别向两极中通入乙烷和氧气,电极反应为:C2H6+18OH--14e- = 2CO32-+12H2O;7H2O+7/2O2+14e- = 14OH-。有关此电池的推断错误的是
A.通氧气的电极为电池的负极
B.参加反应的O2与C2H6的物质的量之比为7/2
C.放电一段时间后,KOH的物质的量浓度将下降
D.在放电过程中,电解质溶液中CO32-物质的量浓度一直在增加
14.在下列叙述中,正确的是
A.液体的温度一定时,悬浮在液体中的微粒越大,布朗运动越显著
B.一定质量的气体保持温度不变,使其压强增大气体的体积也将增大
C.物体的温度一定时,物体的内能可能增大
D.当两个分子之间的距离逐渐减小时,它们相互作用的势能也一定逐渐减小
15.赤道附近地磁场方向向北,同时存在方向竖直向下的电场.若在该处发射一电子,电子沿直线飞行而不发生偏转.则该电子的飞行方向为
A.水平向东 B.水平向西 C.竖直向上 D.竖直向下
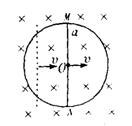
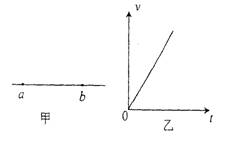 16.如图(甲)是某电场中的一条电场线,a、
16.如图(甲)是某电场中的一条电场线,a、
b是这条线上的两点.若将一负点电荷从a点由
静止释放,负电荷只受电场力作用,沿电场线从
a运动到b.在这过程中,电荷的速度一时间图线
如图(乙)所示,比较a、b两点电势的高低和场强
的大小
A.![]() a>
a>![]() b,Ea=Eb
B.
b,Ea=Eb
B.![]() a>
a>![]() b,Ea<Eb
b,Ea<Eb
C.![]() a<
a<![]() b,Ea>Eb D.
b,Ea>Eb D.![]() a<
a<![]() b,Ea=Eb
b,Ea=Eb
17.质量为m的物体在沿斜面向上的拉力F作用下,沿放在水平地面上的质量为M的粗糙斜面匀速下滑,在此过程中斜面体保持静止,则地面对斜面体
A. 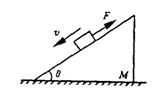 无摩擦力
无摩擦力
B.有水平向左的摩擦力
C.支持力等于(2m+M)g
D.支持力大于(m+M)g
![]() 18.沿x轴方向的一条细绳上有o、a、b、 c四点,oa=ab,bc=5ab.质点o在垂直于x轴方向做简谐运动,沿x轴传播形成横波.t=0时刻,o点开始向上运动,经t=0.2s,o点第一次到达上方最大位移处,这时a点才开
18.沿x轴方向的一条细绳上有o、a、b、 c四点,oa=ab,bc=5ab.质点o在垂直于x轴方向做简谐运动,沿x轴传播形成横波.t=0时刻,o点开始向上运动,经t=0.2s,o点第一次到达上方最大位移处,这时a点才开
始往上运动.由此可以判断,在t=2.6s时刻,
质点b和c的运动情况是
A.b点位于x轴下方 B.c点位于x轴上方
C.b点正向下运动 D.c点正向上运动
19.如图所示的实验装置中,平行板电容器的极板A与一灵敏的静电计相接,极板B接地,若极板B向上平移,由观察到的静电计指针的变化作出平行板电容器电容变小的结论的依据是
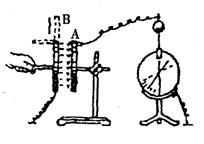 A.两极板间的电压不变,极板上的电量变小
A.两极板间的电压不变,极板上的电量变小
B.两极板间的电压不变,极板上的电量变大
C.极板上的电量几乎不变,两极板间的电压变小
D.极板上的电量几乎不变,两极板间的电压变大
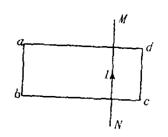 20.如图所示,MN是一根固定的通电长直导线,电流方向向上,今将一金属线框abcd放在导线上,让线框的位置偏向导线的左边,两者彼此绝缘,当导线中的电流突然增大时,线框整体受力的情况为
20.如图所示,MN是一根固定的通电长直导线,电流方向向上,今将一金属线框abcd放在导线上,让线框的位置偏向导线的左边,两者彼此绝缘,当导线中的电流突然增大时,线框整体受力的情况为
A.受力向右
B.受力向左
C.受力向上
D.受力为零
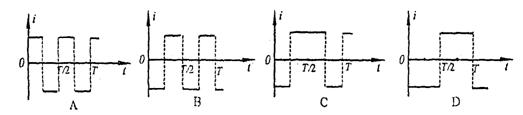
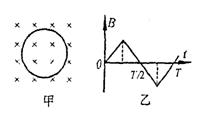 21.如图(甲)所示.一闭合金属圆环处在垂直圆环平面的匀强磁场中。若磁感强度B随时间t按如图(乙)所示的规律变化,设图中
21.如图(甲)所示.一闭合金属圆环处在垂直圆环平面的匀强磁场中。若磁感强度B随时间t按如图(乙)所示的规律变化,设图中
垂直纸面向里为磁场的正方向,环中感应电流沿
顺时针方向为正方向。则环中电流随时间变化的
图象可能是下图中的
第II卷(非选择题,共174分)
 22.(17分)I.某同学在“测定匀变速直线运动的加速度”的实验中,电磁打点计时器接“6V,50Hz”的电源,打出的纸带如图所示,则物体运动的加速度为______m/s2,如果实验时电路交流电的频率低于50Hz,而在实验中仍按频率等于50Hz进行计算,则算出的加速度比物体实际的加速度值偏___________。(填“大”或“小”).
22.(17分)I.某同学在“测定匀变速直线运动的加速度”的实验中,电磁打点计时器接“6V,50Hz”的电源,打出的纸带如图所示,则物体运动的加速度为______m/s2,如果实验时电路交流电的频率低于50Hz,而在实验中仍按频率等于50Hz进行计算,则算出的加速度比物体实际的加速度值偏___________。(填“大”或“小”).
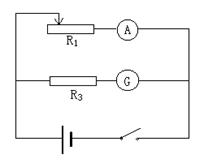
II.在测定一节干电池的电动势和内电阻的实验中,某研究小组,只备有下列器 材:
①干电池(电动势约1.5V,其精确值待定;内电阻小于1.0Ω,其精确值待定。)
②电流表G(满偏电流3mA,内阻Rg=10Ω)
③电流表A(0~0.6A,内阻0.1Ω) ④滑动变阻器R1(0~20Ω,10A)
⑤滑动变阻器R2(0~100Ω,1A) ⑥定值电阻R3=990Ω ⑦开关、导线若干
 (1)为了简便且较准确地测定该干电池的电动势和内电阻,研究小组计划自行设计电路,经过实验采集多组数据,利用计算机
(1)为了简便且较准确地测定该干电池的电动势和内电阻,研究小组计划自行设计电路,经过实验采集多组数据,利用计算机
绘制图表后进行较精确的计算。那么,他们
应该选用的滑动变阻器是___________(填写
字母代号)
(2)请在线框内画出你利用本题提供的
器材所设计的测量电池电动势和内阻的实验
电路图(标明相应器材的字母代号).
23.(15分)把总电阻为2R的均匀电阻丝焊接成一半径为a的圆环,水平固定在竖直向下的磁感应强度为B的匀强磁场中,如图所示,一长度为2a,电阻等于R,粗细均匀的金属棒MN放在圆环上,它与圆环始终保持良好的电接触,当金属棒以恒定速度![]() 向右移动经过环心O时,求:
向右移动经过环心O时,求:
(1)棒上电流的大小和方向及棒两端的电压UMN.
 (2)在圆环和金属棒上消耗的总热功率.
(2)在圆环和金属棒上消耗的总热功率.
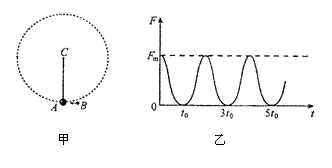
24.(18分)图甲所示为一根竖直悬挂的不可伸长的轻绳,下端拴一小物块A,上端固定在C点且与一能测量绳的拉力的测力传感器相连.已知有一质量为m0的子弹B沿水平方向以速度![]() 射入A内(未穿透),接着两者一起绕C点在竖直面内做圆周运动.在各种阻力都可忽略的条件下测力传感器测得绳的拉力F随时间t的变化关系如图所示.已知子弹射入的时间极短,且图乙中t=o为A、B开始以相同速度运动的时刻,根据力学规律和题中(包括图)提供的信息,求A的质量m和轻绳的长度L.
射入A内(未穿透),接着两者一起绕C点在竖直面内做圆周运动.在各种阻力都可忽略的条件下测力传感器测得绳的拉力F随时间t的变化关系如图所示.已知子弹射入的时间极短,且图乙中t=o为A、B开始以相同速度运动的时刻,根据力学规律和题中(包括图)提供的信息,求A的质量m和轻绳的长度L.
 |
25.(22分) 如图,在xoy平面内,I象限中有匀强电场,场强大小为E,方向沿y轴正方向.在x轴的下方有匀强磁场,磁感强度大小为B,方向垂直于纸面向里.今 有一个质量为m,电量为e的电子(不计重力),从y轴上的P点以初速度![]() 垂直于电场方向进入电场。经电场偏转后,沿着与x轴正方向成45°进入磁场,并能返回到原出发点P.求:
垂直于电场方向进入电场。经电场偏转后,沿着与x轴正方向成45°进入磁场,并能返回到原出发点P.求:
(1)
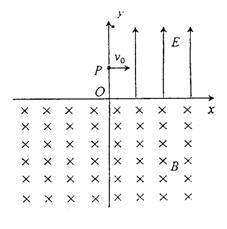 P点离坐标原点的距离h.
P点离坐标原点的距离h.
(2) 电子从P点出发经多长时间第一
次返回P点?
26.X、Y、Z、W四种元素都位于周期表中的短周期,且原子序数X<Y<Z<W。X原子和Y原子的最外层电子数之和与Z原子最外层电子数相等;X的原子半径是自然界元素中原子半径最小的;W原子和Y原子最外层电子数之和为Z原子最外层电子数的2倍,W原子最外层电子数为其电子层的3倍。
(1)推断这四种元素的名称,它们分别是
X_________Y_________Z_________ W_________
(2)写出由上述四种元素组成的既能与盐酸反应又能与NaOH溶液反应的常见物质的化学式____________________。
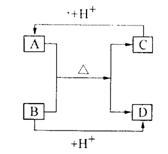 (3)A、B、C、D分别由X、Z、W中的二种原子组成为常见的含有相同电子数的分子和离子,其中A是由5个原子组成,它们之间
(3)A、B、C、D分别由X、Z、W中的二种原子组成为常见的含有相同电子数的分子和离子,其中A是由5个原子组成,它们之间
有如图所示的关系:
①A、B的电子式分别为:
A_________B_________
②B、C、D三种粒子结合质子的能力(用粒子符号表示)
_________>_________>_________,其理由是______________________________。
27.(13分)最近某研究所成功地将石油裂解产物甲经过下述反应,合成了重要有机工业原料丙:甲+CO+H2![]() 乙,乙+H2
乙,乙+H2![]() 丙。
丙。
(1)甲是一种烃,含碳质量分数为85.7%,能使溴水褪色,4.2g甲消耗的溴为16.0g,写出甲的名称__________________。
(2)乙能发生银镜反应而丙不能,丙能进行酯化反应而乙不能,乙和丙经氧化后可得同一种直链羧酸,写出乙和丙的结构简式________________,_________________。
(3)当实验室仅有CuCl2、CH3COOH、C2H5OH、NaOH和水等几种试剂时,如何判断丙中是否含有少量乙?
_______________________________________________________________
(4)在石油裂解时尚含有比甲少一个碳原子的同系物丁,试以丁为原料,合成乙和丙的同系物各一种,写出化学方程式。
①__________________。②__________________。
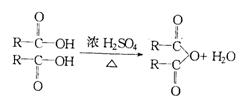
28.(12分)已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如:
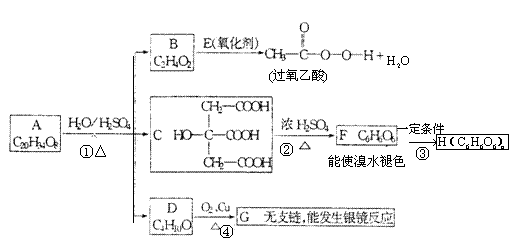 某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。
某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。
⑴指出反应类型
①_________②_________③_________④_________
⑵写出B+E→CH3COOOH+H2O的化学方程式
_______________________________________________________________
⑶写出D的结构简式____________________________________
⑷1mol C分别和足量的金属Na,NaOH反应,消耗Na与NaOH物质的量之比是__________________。
⑸写出F→H的化学反应方程式:________________________________________。
29.(13分)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成;第二,__________________。过氧化钠跟水反应的化学方程式是__________________
__________,其中还原剂是_________。过氧化钠与水反应所得溶液加入到含Fe3+、Al3+的溶液中,发生的反应用离子方程式表示为____________________________________。
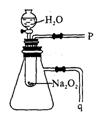 (2)某研究性学习小组拟用下图装置进行实验,以证明上述结论。
(2)某研究性学习小组拟用下图装置进行实验,以证明上述结论。
用以验证第一条结论的实验方法是__________________。
用以验证第二条结论的实验方法及现象是____________
___________________________________________。
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴人酚酞试液,发现溶液变红,振荡后,红色褪去。为探究此现象,该小组同学通过查阅有关资料得知:过氧化钠跟水反应可生成过氧化氢,过氧化氢具有强氧化性和漂白性。请设计一个简单的实验,证明过氧化钠和足量水充分反应后的溶液中有过氧化氢存在。现有硫化钠溶液、亚硫酸钠溶液、硫酸亚铁溶液、碘化钾溶液、红色布条等,请从中选择试剂,加以验证(只要求列出实验所用的试剂及观察到的现象)
试剂:_________________________________________________
现象:_________________________________________________
30.(12分)2l世纪的交通工具将采用新一代无机非金属材料制成的无水冷发动机。 这类材料中研究较多的要数化合物G。
(1)近年研究指出,G可以由化合物E(含两种元素)与NH3反应而成,同时产生HCl气体。G的相对分子质量为140,分子中硅元素的质量分数为60%,另有元素Y。请推断:
①化合物G的化学式为_____________________;
②反应消耗1mol NH3,同时生成3mol HCl,组成化合物E的元素是_________和__________;
③由lmolNH3和0.75mol E恰好完全反应,化合物E的分子式为______________。
(2)粉末状G对空气中氧气和水都不稳定。分解产物中都有一种酸性氧化物,它是工业上生产玻璃、水泥、陶瓷的主要原料,遇氧分解的另一种产物是一种单质;遇水分解的另一种产物是该种单质元素的氢化物。请用反应方程式说明化合物G遇水和氧气的分解情况。
(3)为了使化合物G能成为新一代汽车发动机材料,现采用常压下在G中添加氧化铝,经高温烧结制成一种高强度、超硬度、耐高温、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛纶”,化学通式可表达为Si6-xAlxOxY8-x 。在接近于1700℃时x的极限值约为4.0,在1400℃时x为2.0,以保持整个化合物呈电中性。试问:
①在不同温度时,赛纶中各元素的化合价为Si_______,Al_______,O_______,Y_______;
②分别计算赛纶的总相对分子质量和(Al,O)两元素的质量分数与x的关系。![]()
31、设有两个纯种小麦,一为高秆(D易倒伏)能抗锈病(T),另一为矮秆(d抗倒伏)易染锈病(t),这两对相对性状独立遗传。现分别用杂交育种和单倍体育种来培育矮秆抗锈病的新品种。请回答:
(1)杂交育种培育矮秆抗锈病品种的步骤是:
高秆抗锈病x矮秆易染锈病![]() 稳定遗传的矮秆抗锈病新品种
稳定遗传的矮秆抗锈病新品种
①过程a叫____________,b叫____________。
②过程c的处理方法是________________________。
③F1的基因型是____________,表现型是____________,能稳定遗传的矮秆抗锈病新品种的基因型就是____________。
(2)单倍体育种培育矮秆抗锈病新品种的步骤是:
高秆抗锈病x矮秆易染锈病![]() ddTT植株
ddTT植株
①过程d叫____________,e是指____________。
②过程f是指________________________。
(3)对比上述两种方法,可以得出的结论是________________________。
32、黄瓜的植株既开雄花又开雌花,雄花和雌花容易分辩。现在生物园里有几株黄瓜即将开花,为你提供必要的器具和药品,请你完成下面的实验方案,以证明黄瓜的子房发育成果实需要种子提供的生长素。
器具和药品:透明纸袋、回形针、小纸牌、剪刀、镊子、毛笔、烧杯、适宜浓度的生长素溶液。
实验方案:
步骤一:选择一批发育正常,即将开放的黄瓜雌花,为每朵花套上透明纸袋.用回形针将袋子固定好,然好将这些雌花分为三组,分别挂上1、2、3号小纸牌。
步骤二:
结果预测:第一组雌花:____________;第二组雌花:____________;第三组雌花:____________。
33、将一支黑藻放在水中,如图所示,计算藻枝放出的气泡数以进行的光合作用的测定,改变灯与烧杯的距离行的测定,结果如表。
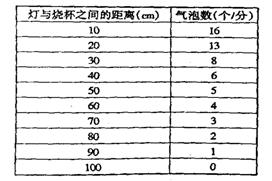
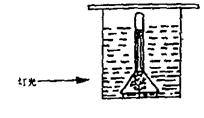
(1)画图表示表中数据。
(2)从表中你能得出什么结论____________。
(3)假设将灯放在距烧杯30cm处:
①向水中放入几只小的活虾,会有什么影响____________;原因是____________
________________________________________________________________________。
②剪掉黑藻的几片叶子,会有什么影响____________;原因是________________
____________________________________________________________。
(4)现给你补加如下器材及药品,请设计一个实验证明光合作用带要二氧化碳:
烧杯 酒精灯 石棉网 碳酸氢钠溶液 稀醋酸 自来水
第一步:____________________________________________________________ 第二步:____________________________________________________________
第三步:将黑藻在暗室中放2—3天,然后取两等份分别放人A、B装置内,灯光在一定距离照射一段时间后取出,用乙醇脱色,清水漂洗,滴上碘液,在显傲镜下观察制片。A装置中的黑藻的叶绿体呈蓝色,B装置中的黑藻的叶绿体呈淡黄色。
化学第七次月考答卷

生物第七次月考答卷
31、(1)①____________,____________
②____________ ③____________ ____________ ____________
(2)①____________ ____________ ②____________
③________________________________________________
32、步骤二:
结果预测:第一组雌花______________,第二组雌花______________,第三组雌花______________。
33、⑴画图:
⑵____________
⑶①____________ ________________________
②____________ ________________________
⑷第一步:___________________________________________________________
__________________________________________________________________
第二步:__________________________________________________________
____________________________________________________________________
生物第七次月考参考答案
1-5 BAADC
31、(1)①杂交 自交 ②自交和选择 ③DdTt 高秆抗锈病 ddtt
(2)①杂交 花药离体培养 ②用秋水仙素处理
(3)单倍体育种可以明显缩短育种年限
32、待纸袋中雌花开放后,打开第一组的纸袋,授以黄瓜的花粉后继续套上纸袋;打开第二组的纸袋,在其柱头上涂抹适宜浓度酌生长京溶液后继续套上纸袋;第三组不做任何处理,几天后将纸袋取下。(各种处理的组别可以不按上述顺序;不要求考生对某些技术细节如怎样授粉等作出具体说明) 结果预测:结出有籽黄瓜 结出无籽黄瓜 不结黄瓜,枯萎脱落。
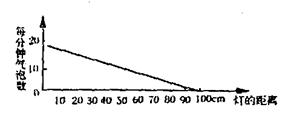 33、(1)
33、(1)
(2)光厢强度与光合作用有关 (3)①每分钟气泡数增加;虾呼吸产生CO2使黑藻的光合作用效率增强,故产生的O2增多。②每分钟气泡少;剪掉部分叶子后,叶绿体数量减少,光合作用效率减弱,放出O2减少。(4)①将盛自来水的烧杯放在三脚架的石棉网上,用酒精灯加热煮沸自来水除去CO2冷却待用 ②将除去CO2的自来水均分到A、D两个装置中,在A装置中再加入适量![]() 溶液和稀醋酸。
溶液和稀醋酸。
化学第七次月考参考答案
I 卷
6、C 7、B 8、B 9、D 10、D 11、B 12、C 13、A
II 卷
26、(共12分)⑴X 氢 Y 碳 Z 氮 W 氧(各1分,共4分)
⑵NH4HCO3或(NH4)2CO3 (2分)
|
⑷OH->NH3>H2O (2分) 碱性越强,结合质子的能力越强。(2分)
27、(共13分)⑴丙烯 (2分)
⑵乙:CH3CH2CH2CHO 丙:CH3CH2CH2CH2OH (各2分,共4分)
⑶取一定量的NaOH溶液,滴入适量CuCl2溶液得新制Cu(OH)2。向制得的新制Cu(OH)2中加入待测试液,加热,若有红色沉淀生成,说明丙中含有乙,反之不含乙。(3分)
⑷CH2=
CH2+CO+H2![]() CH3CH2CHO(2分)
CH3CH2CHO(2分)
![]() CH3CH2CHO+ H2
CH3CH2CHO+ H2![]() CH3CH2CH2OH(2分)
CH3CH2CH2OH(2分)
28、(共12分)⑴①水解反应 ②消去反应 ③加聚反应 ④氧化反应 (各1分,共4分)
⑵CH3COOH+H2O2→CH3COOOH+H2O(2分)
⑶CH3CH2CH2CH2OH(1分) 4种(1分)
⑷4:3(2分)
|
|
![]() (2分)
(2分)
29、(共13分)⑴该反应是放热反应(2分) 2Na2O2+2H2O = 4NaOH+O2↑(1分) Na2O2(1分)
Fe3++3OH-=Fe(OH)3↓ Al3++3OH-=Al(OH)3↓ Al(OH)3+ OH-=AlO2-+2H2O(各1分,共3分)
⑵用带火星的木条靠近导管口P处,木条复燃(2分)
将导管q浸入水中,反应过程中导管口有气泡冒出。(2分)
⑶Na2S溶液(1分) 溶液变浑浊(1分)
或有色布条 布条褪色
30、(共12分)⑴①Si3N4(2分) ②Si和Cl(1分) ③SiCl4(1分)
⑵Si3N4+6H2O=3SiO2+4NH3↑(2分),Si3N4+3O 2=3SiO2+2N2↑(2分)
⑶①Si:+4 Al:+3 O:-2 N:-3(2分)
②M总 = 28(6-x)+27x+16x+14(8-x)=280+x
![]() (Al、O)%=
(Al、O)%=![]() ×100%
×100%
当x=2 (Al、O)%=30.5%
当x=4 (Al、O)%=60.6%
∴随温度升高,x增大, (Al、O)%增大
物理第七次月考参考答案
一、选择题
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| C | A | D | B | A | D | A | C |
 二、非选择题
二、非选择题
22、(17分)
I 9.4(4分),大(3分)
II、(1)R(4分)
(2)(6分)
23、(15分)
⑴感应电流方向为N→M ……………………………………………3分
![]() …………………………………………………3分
…………………………………………………3分
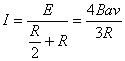 ……………………………………………3分
……………………………………………3分
![]() ……………………………………………3分
……………………………………………3分
⑵ ![]() …………………………………………………3分
…………………………………………………3分
24、(18分)
设V1表示B陷入A内时即t=0时A、B的速度;V2表示运动到最高点时的速度.
![]()
![]() …………………………………3分
…………………………………3分
![]() …………………………3分
…………………………3分
![]() ………………………3分
………………………3分
![]() ……3分
……3分
由图可知
![]() ……………………………………1分
……………………………………1分
![]() ……………………………………1分
……………………………………1分
由以上各式解得
![]() ……………………………………2分
……………………………………2分
![]() ……………………………………2分
……………………………………2分
25、(22分)
(1) 电子经过A点的速度大小为
![]() …………………………4分
…………………………4分
由动能定理
![]() …………………………4分
…………………………4分
∴ ![]() ………………………………………2分
………………………………………2分
(2)电子从P到A ![]() ………………………3分
………………………3分
电子作圆周运动
![]() ………………………………………3分
………………………………………3分
电子作匀速直线运动![]() ……………………3分
……………………3分
∴![]() ………………………3分
………………………3分
