高中学生学科素质训练
高三下学期理科综合同步测试(1)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分300分。考试时间150分钟。
第Ⅰ卷(选择题共126分)
可能用到的相对原子量:H-1,C-12,O-16,Cl-35.5,Mn-55。
本卷共21题,每题6分。在下列各题的四个选项中,只有一个选项符合题目要求。
1.下列各项生理活动中,能产生水的是 ( )
A.人体内淀粉彻底消化分解的过程
B.长跑过程中,人体骨骼肌的主要供能过程
C.高等绿色植物的光反应过程
D.肝脏细胞中肝糖元的分解过程
2.下面两图分别表示肺泡和组织中的气体交换,P(O2)和P(CO2)分别代表O2和CO2的分压,
其下面括号中的数值单位是千帕(KPa)。根据图中数值的变化,判断甲、乙图中血流的
方向分别是 ( )

A.A→B C→D B.A→B D→C
C.B→A C→D D.B→A D→C
3.过去,主要是根据形态特征对生物进行分类,但近年来出现了以蛋白质或核酸的相似性
作为分类依据的方法。同类蛋白质的氨基酸序列越相似,亲缘关系越近。下面是属于同
类的a、b、c、d4种植物中具有同样功能的蛋白质氨基酸序列(He等代表几种不同的氨
基酸)
a.lle—Thr—Lys—Arg b.lle—Arg—Ser—Arg
c.Thr—Thr—Met—Ser d.lle—Thr—Ser—Arg
以此蛋白质氨基酸序列为依据,按与a种生物的相似程度由高到低为顺序,列出4种植物的亲缘关系,下列正确的是 ( )
A.a—b—c—d B.a—b—d—c C.a—d—b—c D.a—d—c—b
4.现有一待测核酸样品,经检测后,对碱基个数统计和计算得到下列结果:
(A+T)/(G+C)=(A+G)/(T+C)=1
根据此结果,该样品 ( )
A.无法被确定是脱氧核糖核酸还是核糖核酸
B.可被确定为双链DNA
C.无法被确定是单链DNA还是双链DNA
D.可被确定为单链DNA
5.下列哪项事实对达尔文的进化理论具有挑战性 ( )
A.在经常刮大风的海岛上,生活着大批无翅的昆虫
B.人类长期使用杀虫剂,不但没有消灭害虫,反而害虫的抗药性越来越强
C.云南澄江地区寒武纪地层中,突然出现大量新物种的化石,而这些物种的形成大约只用了200万年,这在几十亿年生物进化史上只能说是“一瞬间”
D.通过分子生物学研究,特别是“人类基因组计划”的实施,发现人与其它哺乳动物
之间相同的基因非常多,不同的基因只是少数
6.下列是对农作物I和农作物II在同一土壤中N、P、K三要素肥效试验结果。“+”表示
施肥,“-”表示未施。下列结论正确的是 ( )

A.农作物I的氮素来自固氮菌
B.农作物II的氮素来自固氮菌
C.对农作物I来说,磷钾是必需元素,氮是非必需元素
D.不同的农作物对磷钾的需要量是相同的
7.上海医学遗传研究所成功培育出第一头携带人白蛋白基因的转基因牛,他们还研究出一
种可大大提高基因表达水平的新方法,使转基因动物乳汁中的药物蛋白含量提高30多
倍,标志着我国转基因研究向产业化的目标又迈进了一大步。请问, “基因表达水平”
是指 ( )
A.基因中遗传信息的传递速度 B.基因转录信使RNA的速度
C.基因控制蛋白质合成的速度 D.基因控制性状的速率
8.下列变化不属于化学变化的是 ( )
A.工业上用石墨在高温、高压下制取金刚石 B.绿色植物进行光合作用
C.硫酸铜溶液导电 D.蛋白质的盐析
9.据报道,法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四
中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A.该粒子不显电性 B.该粒子质量比氢原子大
C.该粒子质量数为4 D.在周期表中与氢元素占同一位置
10.下列离子方程式书写正确的是 ( )
A.铁跟盐酸反应:2Fe+6H+ 2Fe3++3H2↑
B.碳酸氢钙溶液跟过量氢氧化钠溶液反应:Ca2++HCO3-+OH- CaCO3↓+H2O
C.次氯酸钙溶液中通入过量的CO2;ClO-+H2O+CO2 HCO3-+HClO
D.氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O AlO2-+4NH4++2H2O
11.四氯乙烯对环境有一定的危害,干洗衣服的干洗剂主要成分是四氯乙烯;家用不粘锅内
侧涂覆物质的主要成分是聚四氟乙烯。关于四氯乙烯和聚四氟乙烯的叙述中正确的是
( )
A.它们都属于纯净物
B.它们都能使酸性高锰酸钾溶液褪色
C.它们的分子中都不含氢原子
D.它们都可由乙烯只发生加成反应得到
12.在密闭容器中,一定量混合气体发生下列反应:a M(g)+b N(g)![]() c W(g),达
c W(g),达
到平衡后,测得M气体的浓度为0.5mol«L-1。当在恒温下,将密闭容器的体积扩大1倍,
再达平衡时,测得M气体的浓度为0.3 mol«L-1。则下列叙述正确的是 ( )
A.反应速率增大 B.平衡向右移动
C.N的转化率提高 D.W的体积分数降低
13.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低
的是 ( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用滴定管量取液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①③⑤⑥ B.①②⑤⑥ C.②③④⑥ D.③④⑤⑥
14.近年来,有科学家在探索利用铝粉作燃料的可能性。假如铝作为一种普遍使用的新型能
源被开发利用,关于其有利因素的下列说法中,你认为哪项是错误的 ( )
A.铝是固体,便于安全运输、贮存
B.单位质量铝燃烧时放出的热量多,燃烧后产物对环境的污染容易控制
C.在地球上,铝矿资源非常丰富
D.我国现在已有足够电力资源可用于制取
15.一只电板煲和一台洗衣机同时并联接入![]() 的交流电源上,均正常工作.
的交流电源上,均正常工作.
用电流表分别测得流过电饭煲的电流是5A;流过洗衣机的电流是0.5A. 则下列说法中正
确的是 ( )
A.电饭煲的电阻为44![]() ,洗衣机电动机线圈的电阻为440
,洗衣机电动机线圈的电阻为440![]()
B.电饭煲消耗的电功率为1555W. 洗衣机电机消耗的功率为155.5W
C.1分钟内电饭煲消耗的电能为6.6×104J,洗衣机电机消耗的电能为6.6×103J
D.电饭煲的发热功率是洗衣机电动机发热功率的10倍
16.人类在探索自然规律的进程中总结了许多科学方法,如分析归纳法、演绎法、等效替代
法、控制变量法、理想实验法等。在下列研究中,运用理想实验法进行研究的是( )
A.爱因斯坦提出光子假说
B.麦克斯韦提出电磁场理论
C.卢瑟福提出原子的核式结构模型
D.伽利略得出力不是维持物体运动原因的结论
17.质量为0.01kg的子弹,以600 m«s-1的水平速度射中一静止在光滑水平面上的质量为0.99kg
的木块,射中后子弹与木块合为一体滑上光滑的足够高的固定斜面,它们滑上斜面的最
大高度为(g取10m«s-2) ( )
A.1.8m B.18m C.180m D.1.8×104m
 18.在冬季,剩有半瓶热水的暖水瓶经过一个夜晚后,第二天拔瓶口
18.在冬季,剩有半瓶热水的暖水瓶经过一个夜晚后,第二天拔瓶口
的软木塞时,觉得塞子很紧,不易拔出来,这其中主要
原因是( )
A.软木塞受潮膨胀
B.瓶口因温度降低而收缩变小
C.白天气温升高,大气压强变大
D.瓶内气体因温度降低而压强减小
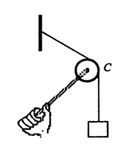
19.手握轻杆,杆的另一端安放有一个小滑轮C,支持着悬挂重
物的绳子,如图所示。现保持滑轮C的位置不变,使杆向
下转动一个角度,则杆对滑轮C的作用力将 ( )
A.变大 B.不变 C.变小 D.无法确定
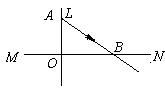 20.如图所示,MN为透镜L的主轴,AB是一条入射光线从左边
20.如图所示,MN为透镜L的主轴,AB是一条入射光线从左边
射向透镜L后的折射光线,由此可以判定下列说法中正确的是
( )
A.若B是透镜L的焦点,AB的入射光线不一定平行于主轴
B.若透镜L是凸透镜,B一定是透镜L的焦点
C.若AB的入射光线平行于主轴,透镜L不一定是凸透镜
D.若B是透镜L的焦点,透镜L一定是凸透镜
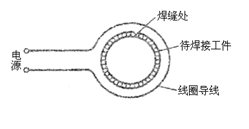 21.在生产自行车车架等产品时,需要进行焊接操
21.在生产自行车车架等产品时,需要进行焊接操
作。如图为一种焊接操作示意图,需要焊接的
物体放在线圈导线中间,且与线圈导线绝缘,
当线圈导线与电源接通后,使待焊接工件产生
电流,由于焊缝处的接触电阻较大,致使温度
升高,将金属熔化,焊接在一起。关于这种焊
接原理正确的说法是( )
A.电源在线圈中产生较大的恒定电流,该电流流过焊接工件产生较大的焦耳热
B.电流在线圈中产生适当的恒定电流,该电流使焊接工件产生感应电流而产生焦耳热
C.电源在线圈中产生高频交变电流,该电流使焊接工件产生感应电流而产生焦耳热
D.电源在线圈中产生高频交变电流,该电流产生的高频微波辐射,深入焊接工件内部,
产生焦耳热
第Ⅱ卷(非选择题共174分)
本卷共10题,174分。
22.阅读下面短文,回答有关问题:(12分)
自中国广东严重急性呼吸道综合症(SARS,即非典型肺炎)感染事件爆发以后,香港、新加坡、越南、加拿大、德国、美国、台湾等国家和地区也陆续出现相同的感染病例。
世界卫生组织(WHO)正通过一项国际多医学研究中心计划,加速找出非典型肺炎的致病原因和治疗方法。目前找到的两个可能致病原因是粘病毒和冠状病毒。
非典型肺炎还没有特定的疗法。但是,世界各地的医务人员一直在用抗病毒药物和类固醇药物治疗。据路透社消息,香港医生尝试从已康复的非典型肺炎病人体内取得血清,用来治疗病情严重的病人,结果取得良好的效果,他们的血清成了许多病重者的救命良药。
(1)组成粘病毒和冠状病毒的化学元素一定有
(2)生产抗病毒药物需要的生物技术是
(3)从已康复的非典型肺炎病人体内取得的血清可以成为许多病重者的救命良药,这
是因为康复者血清中有
(4)如用小鼠 细胞与康复者的某一种 细胞融合,所得到
的融合细胞就能大量增殖,产生康复者血清中含有的物质,可以快速使易感者获得
抗病能力和治疗病人。该融合过程需在 的诱导
下完成。
23.(18分)植物对矿质元素的吸收受到诸多环境因素的影响,但不了解植物对矿质元素的
吸收过程是否与光照有关.为探究光的有无对植物吸收矿质元素的影响,请你依据所给材
料和用品设计出实验的方法和步骤,预测可能的实验结果,并分别得出相应的结论.
可能用到的主要材料和用品:生长状况一致的番茄幼苗,缺N的“完全”培养液,适宜
浓度的NaNO3溶液,测定溶液中离子含量的有关器材,广口瓶和量筒等.
(1)方法步骤:
①
② ,
在培养过程中,使各广口瓶中的土壤溶液的温度、通气状况等环境条件相同且适宜。③
培养一定时间后,分别测定广口瓶中 的含量。
(2)可能的实验结果及相应的结论:
① 。
② 。
③ 。
24.(20分)苯佐卡因是一种局部麻醉剂,可用于粘膜溃疡、创面及痔疮的镇痛,一般制成
软膏或栓剂使用。其合成路线如图所示,其中有机物B具有酸性。
|
已知:苯环上的取代有如下定位规律:当苯环上的碳原子连有甲基时,可在其邻位或对位上引入官能团;当苯环上的碳原子连有羧基时,可在其间位上引入官能团。
请写出:(1)反应类型:反应Ⅰ ,反应Ⅱ ;
(2)化合物A、C的结构简式A ,C ;
(3)下列转化的化学方程式
C→D ,B+D→E 。
(4)苯佐卡因有多种同分异构体,其中—NH2直接连在苯环上,分子结构中含有-COOR
官能团,且苯环上的一氯取代物只有两种的同分异构体共有6种,除苯佐卡因外,
其中3种的结构简式是:
![]()
则剩余两种同分异构体的结构简式为 、 。
25.(15分)超细氮化铝粉末被广泛应用于大规模集成电路生产领域。其制取原理为:
Al2O3+3C+N2![]() 2AlN+3CO
2AlN+3CO
由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质,为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的氢氧化钠溶液中共热并蒸干,AlN跟氢氧化钠
溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为_________________________。
②该样品中的AlN的质量分数为_____________。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应
后测得气体的密度为1.34g·L-1(已折成标准状况,AlN不跟O2反应)。该样品中含
杂质炭_____g。
26.(16分)酒精是一种优质液体燃料,它燃烧值高,无污染,无固体残留物,但携带或运
输则不如固体物质方便。如在酒精中加入一定的添加剂,可制出固体酒精。其配制方法
如下:
①将1kgNaOH加入10L95%的酒精中溶解,配制成0.1g.mL-1的NaOH酒精溶液备用。
②将82L95%的酒精和6.5kg硬脂酸加入带搅拌器和温度计的装置,用水浴加热至60℃~
70℃,在不断搅拌下使硬脂酸全部溶解。
③加入0.5kgCu(NO3)2,搅拌均匀。
④随后慢慢滴加配制的0.1g.mL-1的NaOH酒精溶液,使溶液保持微沸。整个过程约30
分钟完成。
⑤放置冷却至50℃~60℃左右,将溶液倒入模具,凝固后用塑料袋包装即得成品。
该方法中制得的硬脂酸钠具有疏松框架结构,似海绵吸水一样“吸收”了酒精。该产品碱性低、灼烧残渣少,像蜡烛一样可以用刀任意切割,放在铁板、砖块等上面即可点燃,工艺简单,价格便宜,无污染。阅读以上材料,思考并回答下列问题:
(1)酒精是一种优良的有机溶剂,为什么能用酒精来配制0.1g.mL-1的NaOH酒精溶液_____________________________________________________________。
(2)NaOH是强碱,但制成的固体酒精碱性很低。通过计算说明原因。
_______________________________________________________________________。
(3)此固体酒精燃烧后剩余的少量残渣是____________________________________。
(4)要在固体酒精中加入硝酸铜的原因是______________________________________。
27.(19分)已知NH3与CuO在加热条件下发生如下反应:
3CuO+2NH3=N2+3Cu+3H2O
某学校化学兴趣小组要证明如图16-1-A装置中产生的气体成分。请从下图中选择适当的装置(各装置可以重复使用)完成下列各个问题:

(1)正确的排列序号为__________________________。
(2)D中盛装____________试剂,作用是___________________。
(3)C装置需使用二次,它的第一次作用是______________,第二次作用是___________。
(4)B装置的作用是________________。
28.(16分)如图所示,质量M=4kg的木滑板B静止放在光滑水平面上,滑板右端固定着
一根轻质弹簧,弹簧的自由端C到滑板左端的距离l=0.5m,这段滑板与木块A之间的
动摩擦因数μ=0.2;而弹簧自由端C端到弹簧固定端D所对应的滑板上表面光滑。可
视为质点的小木块A质量m=1kg,原来静止于滑板的左端。当滑板B受水平向左的恒
力F=14N作用时间t后撤去,木块A恰好到达弹簧的自由端C处。假没A、B间的最
大静摩擦力跟滑动摩擦力相等,g取10m/s2,试求:
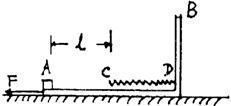
(1)水平恒力F的作用时间t;
(2)木块A压缩弹簧过程中弹簧的最大弹性势能。
29.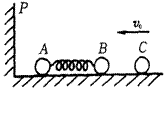 (18分)在原子核物理中,研究核子与核子关联的最有效途径是“双电荷交换反应”。这
(18分)在原子核物理中,研究核子与核子关联的最有效途径是“双电荷交换反应”。这
类反应的前半部分过程和下述力学模型类似。两个小球A和B的轻质弹簧相连,在光滑
的水平直轨道上处于静止状态。在它们左边有一垂直于轨道的固定档板P,右边有一个
小球C沿轨道以速度vo射向B球,如图所示,C与B发生
碰撞并立即结成一个整体D。在它们继续向左运动的过程
中,当弹簧长度变到最短时,长度突然被锁定,不再改变。
然后A球与挡板P发生碰撞,碰撞后A、D都静止不动。
A与P接触而不粘连。过一段时间,突然解除锁定(锁定
及解除锁定均无机械能损失)。已知A、B、C三球的质量
均为m。
求:
(1)弹簧长度刚被锁定后A的速度;
(2)在A离开挡板P之后的运动过程中,弹簧的最大弹性势能。
30.(15分)一种仪器使用的小型电池标称电压为9V,允许电池输出的最大电流为50mA,
为了测定这个电池的电动势和内电阻,实验室利用了如图8-17左所示电路,图中电压表
内阻很大,可不考虑对电路的影响,R为电阻箱,阻值范围为0-9999Ω,R0是保护电
阻。
|
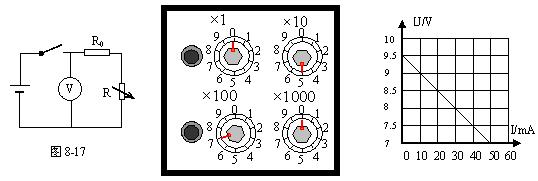
(1)实验室中备有的定值电阻有以下几种规格
A.10Ω、5W B.200Ω、![]() W C.800Ω、
W C.800Ω、![]() W D.1.2kΩ,1W
W D.1.2kΩ,1W
实验时,R0应选用 (填写字母代号)较好。
(2)在实验中,当变阻箱各旋钮调到如图8-17中所示位置后,闭合开关,电压表示数
为9.0V,变阻箱此时电阻为 Ω,电路中通过电阻箱电流为_________mA。
(3)断开开关,调整电阻箱阻值,再闭合开关,读取电压表,多次重复,取得数据后,
作出如图8-17右所示图线,则电源电动势ε= V,内电阻r= Ω。
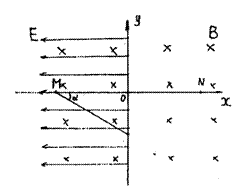 31.(23分)如图所示,在地面附近,坐标系xoy在竖直平面内,空间有沿水平方向垂直于
31.(23分)如图所示,在地面附近,坐标系xoy在竖直平面内,空间有沿水平方向垂直于
纸面向里的匀强磁场,磁感应强度大小为B,在x<0的空间内还有沿x轴负方向的匀强
电场,场强大小为E。一个带正电的油滴经图中
x轴上的M点,始终沿与水平方向成角α=30°
的斜向下的直线运动,进入x>0的区域后能在竖
直平面内做匀速圆周运动,需在x>0的区域内加
一个匀强电场,若带电油滴做圆周运动通过x轴
上的N点,且MO=NO。求:
(1)油滴运动的速率大小;
(2)在x>0空间内所加电场的场强大小和方向;
(3)油滴从x轴上的M点开始到达轴上的N点
所用的时间。
理科综合能力测试题(一)答案和评分标准
1.B,2.B,3.C,4.C,5.C,6.A,7.C,8.D,9.D,10.C,11.C,12.D,13.A,14.D,15.C,16.D,17.A,18.D,19.B,20.A,21.C。
22.(每空2分,共12分)
(1)C、H、O、N、P。(2)发酵工程或细胞工程或基因工程。(3)抗体。(4)骨髓瘤细胞;
效应B淋巴;灭活的仙台病毒或聚乙二醇。
23.(每空3分,共12分)
(1)方法步骤:①在A、B两广口瓶中各加入等量的缺N的“完全”培养液和等量的适宜
浓度的NaNO3溶液,将等量的生长状况一致的番茄幼苗分别培养在A、B两广口瓶中。
②将A瓶置于光照条件下, B瓶置于黑暗条件下。③NO3-(硝酸根离子)
(2)可能的实验结果及相应的结论:①A瓶中NO3-含量比B瓶高,说明光照抑制了植物对
矿质元素的吸收过程;②A瓶中NO3-含量比B瓶低,说明光照促进了植物对矿质元素
的吸收过程;③A、B两瓶中的NO3-含量相近,说明植物对矿质元素的吸收过程不受光
的影响。
24.(20分,化学方程式每个4分,其余每空2分)
(1)硝化反应(或取代反应)酯化反应(或从形式上也可看作是取代反应)。
(2) ![]() ; CH2OH(CHOH)4CHO。
; CH2OH(CHOH)4CHO。
(3)C6H12O6
(葡萄糖)![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
![]()
(4)![]()
25.(15分)
(1)AlN跟氢氧化钠溶液反应,生成NaAlO2、并放出NH3,反应方程式为:
AlN+NaOH+H2O = NaAlO2+NH3↑(4分)
生成0.15molNH3,可计算出10.00g样品中含有AlN的质量为6.15g,所以AlN的质量分数为61.5%。(5分)
(2)加入氧气的物质的量为:![]() =0.09mol
=0.09mol
高温下2.016L(标准状况)O2充分反应,产物可能CO2和CO的混合气体。根据气体产物的密度可计算出气体产物的平均相对分子质量为30。设混合气体中含有CO2xmol,CO ymol,根据氧原子守恒和平均相对分子质量的计算方法可得出:
2x+y=0.18 44x+28y=30(x+y)
解得:x=0.02,y=0.14 。所以,样品中C的质量为:(0.02+0.14)×12 = 1.92g。(6分)。
26.(16分)
(1)乙醇中含有极性基团—OH,是极性分子,NaOH是离子化合物,据相似相溶原理,
NaOH可溶于酒精溶液中。(3分)
(2)n(NaOH)=1000g/40g.mol-1=25mol,n(硬脂酸)=6.6×103g/284g.mol-1=22.89mol,
n[Cu(NO3)2]=0.5×103g/188g.mol-1=2.66mol。中和硬脂酸需NaOH为 22.89mol,剩下的
2.11molNaOH与Cu(NO3)2 反应消耗掉,故固体酒精碱性很低。(5分)
(3)固体酒精是由硬脂酸钠、NaNO3、Cu(OH)2和乙醇组成,点燃后有的燃烧,有的分解,
所以残渣由CuO、NaNO2、Na2CO3组成。(4分)
(4)加入硝酸铜的目的,一是反应掉剩余的NaOH,二是生成的NaNO3和剩余的Cu(NO3)2 在
高温下具有强氧化性,能充分氧化硬脂酸钠,使固体酒精燃烧充分。(4分)
27.(19分,第一问4分,其余每空3分)
实验目的是“证明A装置中产生的气体成分”。在氯化铵溶液中加入金属钠,反应后会产生NH3、H2两种成分,所以实验要求证明的气体是氨气和氢气两种。
(1)由于氨气、氢气两种物质都能跟氧化铜反应,所以实验设计中要特别注意这一点。根
据氨和氢气的性质,可以用石蕊试纸来检验氨气,用灼热的氧化铜检验氢气。为了防止
氨气对检验氢气的干扰,就先检验氨气,再把过量的氨气吸收完后,最后检验氢气。所
以装置的连接顺序应为:A→C→D→C→B。
(2)D装置中应盛装浓硫酸,用于吸收过量的氨气。
(3)第一个装置C是用来检验是否有氨气;第二个装置C是用于检验氨气是否已被完全吸
收。
(4)检验是否有氢气生成。
28.(16分)(1)木块A和滑板B均向左做初速为零的匀加速直线运动。
![]()
![]()
即![]()
![]() 得t=1s
得t=1s
(2)1s末木块A和滑板B的速度分别为
VA=aAt=2×1=2m/s VA=aBt=3×1=3m/s
撤去外力F后,当木块A和滑板B的速度相同时,弹簧压缩量最大,具有最大弹性势能。
根据动量守恒守律,得mvA+MVB=(m+M)v。
得v=2.8m/s。
由能量守恒定律 ![]() 。
。
![]() =0.4J。
=0.4J。
29.(18分)
(1)设C球与B球粘结成D球时,D的速度为v1,由动量守恒,有mv0=2mv1。
当弹簧压至最短时,D与A的速度相等,设此速度为v2,由动量守恒,有2mv1=3mv2,由以上两式得A的速度 v2=![]() v0。
v0。
(2)设弹簧长度被锁定后,贮存在弹簧中的势能为Ep,由机械能守恒,有:
![]() ×2mv12=
×2mv12=![]() 3mv22+Ep。
3mv22+Ep。
撞击P点后,A与D的动能都为零。解除锁定后,当弹簧刚恢复到自然长度时,势能全部转化成D的动能,设D的速度为V3。则有EP=![]() (2m)v32,以后弹簧伸长。A球离开挡板P,并获得速度。当A、D的速度相等时,弹簧伸至最长。设此时的速度为v4,由动量守恒有2mv3=3mv4,当弹簧伸至最长时,其势能最大,设此势能为EP1,由机械能守恒有
(2m)v32,以后弹簧伸长。A球离开挡板P,并获得速度。当A、D的速度相等时,弹簧伸至最长。设此时的速度为v4,由动量守恒有2mv3=3mv4,当弹簧伸至最长时,其势能最大,设此势能为EP1,由机械能守恒有![]() ×2mv32=
×2mv32=![]() 3mv42+Ep1,解以上各式得Ep1=
3mv42+Ep1,解以上各式得Ep1=![]() mv02。
mv02。
30.(15分,每空3分)
(1)B。(2)750;9.5。(3)9.5;50。
31.(1)![]() ,
,![]() 。
。
(2)![]() ;qE=mg;
;qE=mg;![]() ;方向竖直向上。
;方向竖直向上。
(3)qvB=mv2/R。R=mv/qB;![]() ;粒子与y轴交于p点,
;粒子与y轴交于p点,
![]() 。粒子轨迹所对的圆心角为120°,t
= Mp/V + T/3。
。粒子轨迹所对的圆心角为120°,t
= Mp/V + T/3。
由(2)可知:![]() 。
。![]() 。
。
