理科综合第五次月考能力测试
(命题人:黄道炳 朱 斌 张小红; 审题人:刘吉清 杜明军 何文中)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷。全卷300分,150分钟。考试结束后,将答题卷交回
可能用到的原子量: H----1 C-----12 He----4 Cl---35.5 K---39 Ba---137 Na----23
第Ⅰ卷(选择题共21题 每题6分共126分)
一、选择题(本题包括13小题。每小题只有一个选项符合题意。每小题6分)
1.水是细胞的重要组成成分,在生物体内是一种良好的溶剂,是各种生化反应的介质。在下列说法中不正确的是( )
A.休眠或越冬的植物体,往往是自由水与结合水的比例下降
B.水是光合作用的反应物,是最终的电子供体
C.在丙酮酸彻底分解成CO2的过程中必须加水
D.在海洋生态系统中,水是决定生物分布最重要的非生物因素
2.下面各项叙述,只有哪一项符合人体内蛋白质代谢的特点?( )
A.接受了抗原刺激的淋巴细胞,其细胞内的蛋白质合成速度加快
B.因人是异养生物,体内蛋白质合成所需氨基酸只能来自于食物
C.健康成年人摄取过量食物蛋白,排出的尿液中尿素含量不变
D.当糖类和脂肪摄人量都充足时,蛋白质的合成与储存就会增加
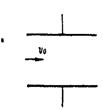
3.下图的曲线分别表示有关生物学过程,对其曲线变化的描述正确的是( )
A.甲图中,A点只有呼吸作用,D点只有光合作用
B.在乙图B点时,害虫种群中抗药个体所占百分比小于在A点时害虫种群中抗药个体所占的百分比
C.生产上常用一定浓度的生长素类似物除去单子叶农作物中的双子叶杂草,丙图中曲线①表示单子叶植物
 |
D.丁图中动物甲比动物乙高等
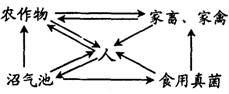 4.下图是农业生态系统的一种结构模式,有关分析中正确的一项是( )
4.下图是农业生态系统的一种结构模式,有关分析中正确的一项是( )
A.农作物和人是该生态系统的主要成分
B.人和畜禽所处的营养级肯定是不同的
C.物质的良性循环,确保了能量的循环利用,减少了废物的积累
D.分解者的有效利用,提高了该生态系统的能量利用率
5.下列关于微生物酶的叙述中,错误的是( )
A.组成酶是胞内酶
B.诱导酶的合成除取决于诱导物以外,还取决于细胞内所含的基因
C.组成酶的合成只受细胞内遗传物质的控制
D.微生物只能通过改变已有酶的催化活性来调节代谢的速率
6、设阿伏加德罗常数为NA,下列叙述正确是
A. 在标准状况下,2.24L三氧化硫中含有的分子数为0.1NA
B. 25℃时,PH=1的盐酸中约有0.1NA OH-
C. 在常温常压下,16gO2和O3的混合物中含有的质子数为NA
D. 0.5molNH3中含有5NA个电子
7、等物质的量的下列物质分别与足量的NaOH溶液完全反应,需要NaOH的量最多的是
A.NaHS04 B.AICl3 C.SiO2 D.![]()
8、1mol铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为
A. 1:1 B. 2:1 C. 3:1 D. 1:3
|
Al![]() O
O![]() +N
+N![]() +3C
2AlN+3CO
+3C
2AlN+3CO
下列叙述正确的是( )
A.在氮化铝的合成反应中,N![]() 还原剂,Al
还原剂,Al![]() O
O![]() 是氧化剂
是氧化剂
B.上述反应中每生成2molAlN,N![]() 得到3mol电子
得到3mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
10、用盐酸、氨水、苛性钠溶液中的任何一种试剂,均可鉴别的一组物质是
A. . AgNO3和AlCl3两种溶液 B. MgCl2和NH4NO3两种溶液
C. FeCl2和FeSO4两种溶液 D NaCl和Na2CO3两种晶体
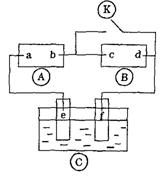 11、右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽。接通电路后发现B上的c点显红色。为实现铁上镀锌,接通K后,使c、d两点短路。
11、右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽。接通电路后发现B上的c点显红色。为实现铁上镀锌,接通K后,使c、d两点短路。
下列叙述正确的是
A.a为直流电源的负极
B. d极发生的反应为![]()
C .f电极为铁板
D. e极发生还原反应
12、向![]()
![]() 的
的![]() 溶液中加入
溶液中加入![]() 某酸,再滴入几滴甲基橙,则溶液呈红色,这种酸可能是
某酸,再滴入几滴甲基橙,则溶液呈红色,这种酸可能是
A.![]() 的醋酸 B.
的醋酸 B.![]() 的甲酸
的甲酸
C.![]() 的硫酸 D.
的硫酸 D.![]() 的硝酸
的硝酸
![]() 13.向容积为2L的固定密闭容器中充人2molX气体和1mo1Y气体,在一定条件下发生如下反应:2X(g)+Y(g)
3R(g);经2s后达到平衡,测得R气体的浓度为0. 6mol/L。下列说法中错误的是
13.向容积为2L的固定密闭容器中充人2molX气体和1mo1Y气体,在一定条件下发生如下反应:2X(g)+Y(g)
3R(g);经2s后达到平衡,测得R气体的浓度为0. 6mol/L。下列说法中错误的是
A.用物质X表示该反应在2s内的平均反应速率为0.2mol/(L·s)
B.平衡时物质X与Y的转化率相等
C.其他条件不变,向容器中再加入1molR气体,达到新的平衡后,R的体积分数不变
D.其他条件不变,加压缩小容器体积时平衡不移动,气体密度和平均相对分子质量增大。
二.本题共8小题,每小题6分,共48分。在每小题给出的四个选项中,有的小题只有一个选项正确;有的小题有多个选项正确。全部选对的得6分选对但不全的得3分,选错或不选的得0分。
14.根据热力学定律和分子动理论,可知下列说法中正确的是( )
A.当分子间距离等于r0时,分子势能一定等于零
B.满足能量守恒定律的过程并不是都可以自发地进行
C.一定质量的气体,如果保持气体的温度不变而使体积减小,则压强将变大
D.温度相同时,分子质量不同的两种气体,其分子平均动能不一定相同
15.要增加单摆在单位时间内的摆动次数,可采取的方法是( )
A.增大摆球的质量 B.缩短摆长 C.减小摆动的角度 D.把单摆移到高山上
16.如图所示,某一线圈在匀强磁场中匀速转动产生的交变电流图像,从图中可知( )
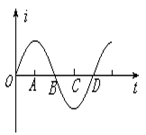 A.在A和C时刻线圈处于中性面位置;
A.在A和C时刻线圈处于中性面位置;
B.在A和C时刻线圈平面与磁场方向平行;
C.在B和D时刻线圈中的磁通量为零;
D.在A和C时刻线圈中的磁通量的变化率为零。
17.下列关于静电场的说法中正确的是( ) ( )
A.在点电荷形成的电场中没有场强相等的两点,但有电势相等的两点
B.正电荷只在电场力作用下,一定从高电势向低电势运动
C.在电场中由静止释放一正检验电荷,它一定沿电场线运动
D .电场强度的方向就是电势降落的方向
 18.如图所示,矩形闭合金属框abcd的平面与匀强磁场垂直,若ab边受竖直向上的磁场力的作用,则可知线框的运动情况是( )
18.如图所示,矩形闭合金属框abcd的平面与匀强磁场垂直,若ab边受竖直向上的磁场力的作用,则可知线框的运动情况是( )
A.向左平动进入磁场 B.向右平动退出磁场
C.沿竖直方向向上平动 D.沿竖直方向向下平动
19.人造地球卫星进入轨道做匀速圆周运动时( )
A. 卫星的运动周期与地球质量无关室
B. B.卫星上的物体不再受到重力的作用
C.卫星在轨道上运行的线速度应大于第一宇宙速度
D.同步卫星都在同一条轨道上运行,轨道在地球赤道平面内
 20.如图所示两个半径相同的半圆形轨道分别竖直放在匀强电场和匀强磁场中.轨道两端在同一高度上.轨道是光滑的.两个相同的带正电小球同时从两轨道左端最高点由静止释放.M、N为轨道的最低点下列说法正确的是( )
20.如图所示两个半径相同的半圆形轨道分别竖直放在匀强电场和匀强磁场中.轨道两端在同一高度上.轨道是光滑的.两个相同的带正电小球同时从两轨道左端最高点由静止释放.M、N为轨道的最低点下列说法正确的是( )
A.两小球到达轨道最低点的速度υM>υN
B.两小球第一次到达轨道最低点时对轨道的压力FM>FN
C.小球第一次到达M点的时间大于小球第一次到N点的时间
D.在磁场中小球一定能到达轨道的另一端,在电场中小球不能到达轨道的另一端
21.如图所示,两平行金属板的间距等于极板的长度,现有重力不计的正离子束以相同的初速度v0平行于两板,从两板正中间射入。第一次在两板间加恒定电压,建立场强为E的匀强电场,则正离子束刚好从上极板边缘飞出。第二次撤去电场,在两板间建立磁感应强度为B、方向垂直于纸面的匀强磁场,正离子束刚好从下极板边缘飞出, 则E和B的大小之比为( )
|
第二部分 非选择题(共174分)
三、本题共10小题。共174分。按题目要求作答。解答题应写出必要的文字说明、方程式和重要演算步骤。只写出最后答案的不能得分。有数值计算的题,答案中必须明确写出数值和单位。
22(18分)实验
(1)(3分)某学校学生在开展“测金属电阻率”:研究性学习括动中,对有关金属(灯泡中的钨丝)、半导体(二极管)、合金(标准电阻),及超导材料的电阻率查阅了大量资料,提出了下列一些说法,你认为正确的有
A.金属温度计是利用金属材料的电阻率随温度升高而不发生显著变化制成的
B.标准电阻是利用合金材料的电阻率几乎不随温度变化而变化制成的
 C.半导体材料的电阻率随温度升高而增大
C.半导体材料的电阻率随温度升高而增大
D.当温度为绝对零度时,某种材料电阻率突然为零,这种现象叫超导现象
(2)在“测金属电阻率”实验中,
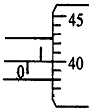
①(3分)螺旋测微器测金属丝的直径的读数如图,则直径d= mm。
②(6分)测得接入电路的金属丝的长度为L,已知其电阻大约为25Ω.在用伏安法准确测其电阻时,有下列器材供选择,除必选电源(电动势1.5V,内阻很小)、导线、开关外,电流表应选 ,电压表应选 ,滑动变阻器应选 。(填代号)
 A1电流表(量程40mA,内阻约0.5Ω)
A1电流表(量程40mA,内阻约0.5Ω)
A2电流表(量程10mA,内阻约0.6Ω)
V1电压表(量程6V,内阻约30kΩ)
V2电压表(量程1.2V,内阻约的20kΩ)
R1滑动变阻器(范围0-10Ω)
R2滑动变阻器(范围0-2kΩ)
③(3分)将设计好的测量电路原理图画在虚框内。
④(3分)若电压表、电流表读数用U、I表示,用上述测得的物理量计算金属丝的电阻率的表示式为
ρ= 。
23(16分)如图所示,足够长的光滑平行金属导轨,相距L,导轨平面与水平面夹角为θ,匀强磁场垂直于导轨平面,已知磁感应强度为B,平行导轨的上端连接一个阻值为R的电阻。一根质量为m,电阻也为R的金属棒ab垂直于导轨放置在导轨上,金属棒从静止开始沿导轨下滑,
求(1):ab棒的最大滑行速度(导轨电阻不计,要求画出ab杆的受力图)
(2)若ab棒从静止开始,沿斜面下滑S距离时,棒刚好达到最大速度。求棒从开始下滑
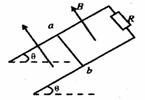 到最大速度过程中,电阻R上产生的热量。
到最大速度过程中,电阻R上产生的热量。
24(18分)在如图10所示的空间区域里,y轴左方有一匀强电场,场强方向跟y轴正方向成60°,大小为![]() ;y轴右方有一垂直纸面向里的匀强磁场,磁感应强度B=0.20T.有一质子以速度v =2.0×
;y轴右方有一垂直纸面向里的匀强磁场,磁感应强度B=0.20T.有一质子以速度v =2.0×![]() m/s,由x轴上的A点(10cm,0)沿与x轴正方向成30°斜向上射入磁场,在磁场中运动一段时间后射入电场,后又回到磁场,经磁场作用后又射入电场.已知质子质量近似为
m/s,由x轴上的A点(10cm,0)沿与x轴正方向成30°斜向上射入磁场,在磁场中运动一段时间后射入电场,后又回到磁场,经磁场作用后又射入电场.已知质子质量近似为
m =1.6×![]() kg,电荷 q=1.6×
kg,电荷 q=1.6×![]() C,质子重力不计. 求:(计算结果保留2位有效数字)
C,质子重力不计. 求:(计算结果保留2位有效数字)
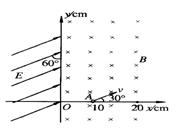 (1)质子在磁场中做圆周运动的半径.
(1)质子在磁场中做圆周运动的半径.
(2)质子从开始运动到第二次到达y轴所经历的时间.
(3)质子第三次到达y轴的位置坐标.
 25(20分)如图,长为L的光滑平台固定在地面上,平台中央有两小物体A和B,彼此接触靠在一起,A的上表面有一半径为R(R<<L)、顶端距台面高h的光滑圆槽,槽顶有一小物体C,A、B、C三者质量均为m,现使物体C由静止沿圆槽下滑,且运动过程中它始终与圆槽接触,求:
25(20分)如图,长为L的光滑平台固定在地面上,平台中央有两小物体A和B,彼此接触靠在一起,A的上表面有一半径为R(R<<L)、顶端距台面高h的光滑圆槽,槽顶有一小物体C,A、B、C三者质量均为m,现使物体C由静止沿圆槽下滑,且运动过程中它始终与圆槽接触,求:
(1)A和B刚分离时,B的速度;
(2)A和B分离后,C能达到距平台的最大高度.
26. (12分)X、Y、Z是三种短周期主簇元素,它们的原子序数依次减小,X为第二周期元素,三种元素的原子核外电子层数之和等于5;Y元素的原子最外层上的电子数是它的电子层数的两倍;X元素的原子最外层电子数是Y和Z两元素的原子的最外层电子数的总和; X和Z可以形成XZ3的化合物。
(1)X、Y、Z分别为 、 、 ;(填元素符号)
(2)XZ3化合物的电子式是 , 实验室制取它的化学反应方程式为:
。
(3)X、Y两种元素的氢化物的稳定性强弱关系是 。(用化学式表示)
27、(13分)下列A-I九种物质之间的转化关系如图所示;其中部分生成物或反应条件已略去。已知:固态单质A与B的浓溶液在一定条件下反应如下。常温下C、E、F都是无色气体。
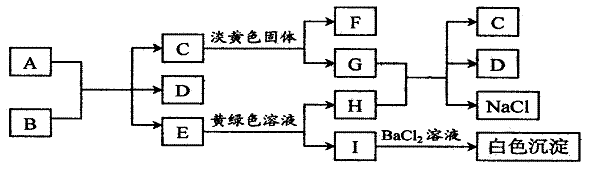 请填空:
请填空:
(1)C属于 分子(极性,非极性) F的化学式是 。
(2) A与B的浓溶液反应的化学方程式是 。
(3)G与H反应的离子方程式是 ,
(4)E转变为H和I的离子方程式是 。
28、(16分)为了测定NaOH固体中Na2CO3杂质的质量分数,甲、乙、丙三个同学分别称取a g固体混合物并设计了如下方案:
(1)甲同学的方案是:将样品溶解于适量水中配成浓溶液,再加入过量氯化钡溶液,过滤、洗涤、烘干,称量得固体b g,则固体混合物中Na2CO3的质量分数为 (用含a、b的式子表示,不必化简),简述洗涤沉淀的操作过程
。
若Ca2+,Ba2+都可以使![]() 沉淀完全,你认为用BaCl2溶液好还是用CaCl2溶液好。(填序号)
。
沉淀完全,你认为用BaCl2溶液好还是用CaCl2溶液好。(填序号)
。
A. CaCl2溶液 B. BaCl2溶液 C. 一样好
(2)乙同学的方案是:将样品溶解后,加入稍过量的氯化钡溶液,再滴入2—3滴酚酞试液,用标准盐酸滴定,乙同学在滴定过程中所需要的主要玻璃仪器有 ,
加入过量氯化钡溶液的目的 。
(3)丙同学的方案如下图所示:
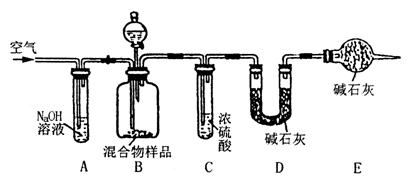
当混合物样品充分反应时,缓慢通入空气的目的是 ,上图中装置A的作用 ;如果没有E,测定结果会 。(填“偏大”或“偏小”或“不影响”)。
29、Ⅰ(12分)、PMMA常被用作光盘的支持基片,PMMA的单体A(C5H802)不溶于水,可以发生以下变化:
已知:B是—种新型汽车燃料,E能发生银镜反应,F与NaHCO3溶液反应能产生气体,G的一氯取代产物H有两种不同的结构。请回答:

(1) G的结构简式 。
F分子中含有的官能团的名称分别是: 。
(2)由F转化成G的反应类型属于(选填序号) 。
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(3)由B与D反应生成E的化学方程式为 。
(4)由A发生加聚反应可得PMMA,该反应的化学方程式是 。
Ⅱ(7分)、A是芳香烃的含氧衍生物。具有以下性质:(1)在一定温度和压强下将A气化,其气体的质量是同温同压下等体积氢气质量的76倍;(2)称取7.6gA,在9.52L(标况)氧气中恰好完全燃烧,得到CO2和水蒸气的混合物,且两者的物质的量之比为2:1。
(1)试通过计算确定烃A的分子式 。
(要求:写出计算分析过程)
(2)A遇三氯化铁溶液不变色,l molA与足量金属钠作用能放出1 molH2,1 molA最多只能与1 molNaOH反应,符合A所有可能的结构简式中:若A苯环上的一元取代物只有二种,则A的结构简式应为 ,若A苯环上的一元取代物共有三种, 则A的结构简式应为 。
30.(18分)水田中生活着一种无色草履虫(单细胞动物),以细菌和真菌为食,但常因与绿藻共生而成为绿色草履虫,该草履虫即使没有食物也能依赖共生的绿藻而生存。
(1)绿藻可以为共生的草履虫生存提供________和________。
(2)现有一批绿色草履虫,请设计一个既能除去共生绿藻,使之成为无色草履虫,又能保证其存活的简单的培养方法:______________________________________。
(3)将破碎的绿色草履虫培养,可以获得共生的绿藻种群。培养液中除须含有无机盐 外,还须置于________处培养。
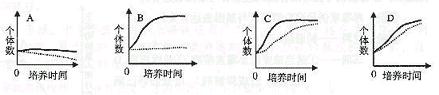
(4)将绿色草履虫和除去绿藻的无色草履虫,在四种实验条件下培养,实验条件是①“有光—食物丰富”,②“有光-食物贫乏”,③“无光-食物丰富”,④“无光-食物贫乏”。下图所示的生长曲线是四种实验条件下所得的结果,则对应于图A.B.C和D结果的实验条件分别是A:________,B:________,C:________,D:________(用序号表示)。绿色草履虫和无色草履虫在暗处共同培养时,在食物上存在着________关系。
31.根据下列实验回答问题(24分)
实验一:甲细菌在基本培养基中单独培养→结果无菌落产生;
甲细菌在完全培养基中单独培养→结果产生了甲菌落。
实验二:乙细菌在基本培养基中单独培养→结果无菌落产生;
乙细菌在完全培养基中单独培养→结果产生了乙菌落。
实验三:甲细菌与乙细菌混合在基本培养基中培养→结果有菌落产生。
(1)若甲细菌能够抗四环素,则抗性基因位于 上,若乙细菌有鞭毛,其菌落特征是 。
(2)如果实验三出现的是一种新菌落,既不是甲菌菌落,也不是乙菌菌落(排除基因突变),对这一实验现象的原因提出你的假设: 。
(3)如果在实验一的培养基中增添甲物质,则会出现甲细菌的菌落;实验二的培养基中增添乙物质,则会出现乙细菌的菌落;实验三是将甲细菌和乙细菌同时培养,结果出现了甲细菌和乙细菌两种菌落。
根据上述实验现象提出你的假设: 。
(4)根据(3)的假设,在下列步骤1和步骤4的基础上继续完成实验的有关内容:
步骤1:甲细菌+基本培养基+甲物质→甲菌落
步骤2: 。
步骤3: 。
根据步骤1—3,得出的结论是 。
步骤4:乙细菌+基本培养基+乙物质→乙菌落
步骤5: 。
步骤6: 。
根据步骤4—6,得出的结论是 。